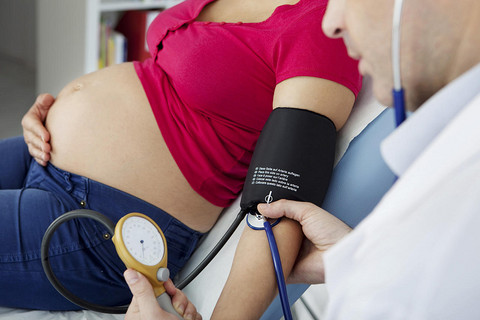
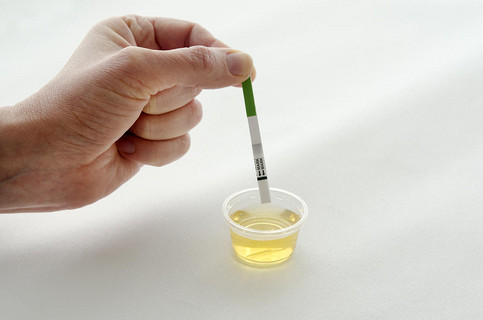
抗原可以当验孕棒用吗试纸
验孕棒检测分阳性和阴性,如果出现两条杠表示尿妊娠试验阳性,可能是怀孕。
如果出现一条杠,表示尿妊娠试验阴性,暂时没有怀孕。
如果没有任何条杠显示,表示尿妊娠试纸失效,需要更换验孕棒重新检测。
验孕棒检测是判断是否怀孕的简单方法,患者可以自查。
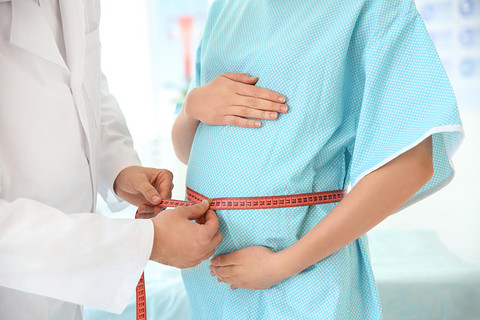
如果女性月经推迟3-5天,尤其是推迟1周左右,此时可以做验孕棒检测自查,取干净容器留取尿液,将验孕棒检测端置入尿液中,几秒之后拿出晾置观察。
验孕棒检测机理是检测尿液中HCG,验孕棒上会有HCG相关抗体,通过抗原抗体反应加着色反应,会显示出两条杠。
如果怀孕之后,女性尿液中有HCG表达,验孕棒会出现两条杠,表现为阳性。

hiv试纸抗原在哪个位置
国家卫生计生委关于印发血站技术操作规程(2015版)的通知国卫医发〔2015〕95号各省、自治区、直辖市卫生计生委,新疆生产建设兵团卫生局:为加强血站能力建设,进一步提升血液安全水平,我委组织制定了《血站技术操作规程(2015版)》。
《血站技术操作规程(2012版)》(卫医政发〔2012〕1号)同时废止。

国家卫生计生委2015年12月前 言《血站技术操作规程(2012版)》自施行以来,对促进血站规范化管理起到重要的作用。
随着血站核酸检测的全面覆盖和血液管理工作要求的进一步提高,原有的“血液检测”部分内容已经不适应当前需要。
指导血站加强能力建设,规范核酸检测操作流程,进一步提升血液安全水平,我委对“血液检测”部分内容进行了修订完善,组织制定了《血站技术操作规程(2015版)》(以下简称《规程》)。
本《规程》正文包括献血者健康检查、全血采集、血液成分制备、血液检测、血液隔离与放行和质量控制6个部分,对所涉及的关键技术要点做出相应规定。
其中一些原则性的规定,血站在制定自身的操作规程时应当根据实际情况进一步细化。
以“宜”表述的内容为推荐性内容。

本《规程》的附录为资料性附录,供血站参考。
各血站应当按照国家相关法律、法规、规章、技术规范和标准,以及本《规程》的要求,结合具体工作实际,编制适合本血站使用的技术操作规程。
如有关血液标准、规范与《规程》存在不一致的地方,以《规程》规定为准。
本《规程》自2016年3月1日起施行。
《血站技术操作规程(2012版)》同时废止。

为不断提升血站质量管理水平和技术能力,《规程》将每3年修订1次。
目 录1献血者健康检查2全血采集3血液成分制备4血液检测5血液隔离与放行6质量控制附录A献血者血红蛋白检测(硫酸铜目测法)附录B血液检测方法的确认附录C血液检测试剂(血清学检测/核酸检测试剂)进货验收与放行记录表附录D血液检测室内质控方法附录E微板法ABO血型定型试验附录F血液质量控制检查方法附录G血袋标签确认方法附录H血站使用的强制检定工作计量器目录附录I献血者健康检查要求1献血者健康检查1.1目的按照国家有关献血者健康检查要求(见附录)的规定,对具有献血意向的人员进行健康检查,对检查结果进行综合分析和判断,做出是否适合献血的结论,保障献血者健康和安全。
1.2核对献血者身份将献血者本人相貌与其有效身份证件原件核对。
有效身份证件包括居民身份证、居民社会保障卡、驾驶证、军(警)官证、士兵证、港澳通行证和台胞证以及外国公民护照等。
1.3登记献血者身份信息核查献血者身份无误后,将献血者身份信息录入血液管理信息系统(以下简称BMIS),具体录入方式有:1)用身份证识读器读取身份信息并存入BMIS,2)填写《献血登记表》,录入BMIS,注意核对信息填写和输入的正确性。
1.4询问和查询既往献血史询问献血者和查询BMIS有无既往献血史。
如献血者曾献血,献血间隔期应符合要求,不处于被暂时或永久屏蔽状态。
1.5履行告知义务请献血者仔细阅读、理解献血前须知内容(见附录)。
1.6健康征询请献血者仔细阅读、理解并如实回答献血前健康征询问题(见附录),体检人员给予必要的指导和沟通。
1.7知情同意请献血者签名,表明献血者已正确理解献血前须知内容并如实回答献血前健康征询问题,自主、自由地决定是否献血。
1.8一般检查按照献血者健康检查要求,对献血者进行一般检查,常规项目包括体重、血压、脉搏等,必要时测量体温。
记录健康检查结果和结论并签名。

1.9献血前血液检测在献血前采集献血者血液标本做血液检测。
在采集血液标本前应核对献血者身份。
检测项目包括血红蛋白(Hb),单采血小板献血者还应检测红细胞比容、血小板计数等项目。

血站可根据实际情况增加ABO血型、丙氨酸氨基转移酶(ALT)等检测项目。
血红蛋白检测可采用目测法,如硫酸铜目测法(见附录A)或试纸条比色法,必要时进一步用仪器检测。
记录检测结果和结论并签名。
1.10健康检查结论1.10.1将献血者健康征询、一般检查以及献血前血液检测的结果与献血者健康检查要求的规定进行对照分析和评价,做出献血者是否符合献血条件的判断并签名。
1.10.2将健康检查结果和结论与献血者沟通。

对于需要永久屏蔽献血的,做好解释工作,对于暂时不适宜献血的,告知不适宜献血的情形解除后,经健康检查合格可以献血。
1.10.3引导适合献血的献血者进入血液采集环节。

2全血采集2.1献血场所配置献血场所的人员、设施、设备和器具、关键物料的配备按有关规定执行。
2.2采血人员准备2.2.1心理调适采血人员调整好心理与情绪,进入为献血者服务工作状态,情绪稳定,工作热情,说话和气,态度和蔼,耐心细致。
2.2.2技术准备熟悉采血技术操作规程,尤其应注意关键控制点和近期变更的操作步骤。
2.2.3着装与配饰采血人员着工作制服,不佩带戒指、手镯(链)等饰物。
2.2.4手卫生采血人员保持手卫生,具体操作按照国家有关医务人员手卫生规范执行。
2.3采血器材准备2.3.1采血器材清单建立采血器材卡片,列出采血位所需的全部器材。
采血人员按卡片准备和核查采血器材的种类和数量。
采血器材的数量与预计采血量相适宜。
一次性使用物品在有效期内且包装完好。
采血器材准备工作应有专人复核。
2.3.2血袋1)无破损、无渗漏,无污染,抗凝剂和保养液无变色,2)处于有效期内,3)宜采用具有留样袋的血袋。
2.3.3标本管1)带有分离胶用于检测病毒核酸的标本管,2)用于血清学检测、ALT和血型检测的标本管。
2.3.4消毒剂1)一般选用含碘消毒剂,对碘过敏者可选用其他消毒剂,2)所用消毒剂应当符合相应的国家标准要求,3)处于有效期内,4)标明启用日期。
2.3.5采血仪(秤)开启并检查采血仪(秤),证实正常运行。
2.3.6热合机开启并检查热合机,证实处于正常状态。

2.4献血者身份核对2.4.1在静脉穿刺前,应核对献血者身份。
2.5献血者沟通与评估2.5.1在血液采集过程中应当加强与献血者的沟通,尤其是进行每一项主要操作之前,应当与献血者沟通并取得配合。
2.5.2询问献血者的既往献血经历、近日休息等情况,评估出现献血不良反应的可能性和不适合献血的情况。
2.5.3观察献血者面部表情和肢体语言,是否处于紧张、害怕甚至恐惧状态。
如发现这些不利情况,则不急于采血,做好宽慰工作,待献血者解除思想顾虑,充分放松后开始准备采血。

2.6静脉及其穿刺路径评估与选择2.6.1穿刺部位的选择应选择无损伤、炎症、皮疹、皮癣、疤痕的皮肤区域为穿刺部位。
2.6.2穿刺静脉的选择1)选择上肢肘部清晰可见、粗大、充盈饱满、弹性好、较固定、不易滑动的静脉,2)常选择的静脉主要有肘正中静脉、头静脉、前臂正中静脉、贵要静脉等,3)用食指指腹上下左右触摸,确定其位置、粗细和弹性,评估并确定穿刺位点和路径,4)使用止血带可使静脉充盈,便于触及和穿刺。
2.7穿刺部位消毒2.7.1用无菌棉蘸取适量消毒剂,以穿刺点为中心,自内向外螺旋式旋转涂拭,消毒面积不小于6 cm×8 cm,作用1~3分钟。
宜消毒2~3遍。
2.7.2不应触摸已消毒的皮肤,不应靠近已消毒的皮肤讲话。
2.8静脉穿刺2.8.1待消毒剂干后方可进行静脉穿刺。
2.8.2采取相应措施(如用止流夹夹住血袋导管)防止空气进入血袋。
手持针柄,取下护针帽,按照预先选定的穿刺部位进行穿刺。
2.8.3穿刺路径为自皮肤穿刺点进入,皮下组织前行约0.5~1.0 cm,进入静脉腔,前行约0.5~1.0 cm。

2.8.4如需第二次穿刺,应当在征得献血者同意后,在另一手臂选择穿刺部位和静脉,使用新采血袋的采血针进行穿刺。
2.9血液采集和混匀2.9.1静脉穿刺成功后,如果使用带留样袋的采血袋,松开留样袋夹子,使更先流出的血液流入留样袋,约15~20 ml,用做血液检测标本。
夹闭留样袋夹子,松开阻塞件下端止流夹,使血液流入采血袋。

如果使用不带留样袋的采血袋,松开夹子,使血液直接流入采血袋,血液采集完成后,应先留取血清学检测标本管,再留取核酸检测标本管。

2.9.2固定针头位置,用敷料保护穿刺点。
2.9.3维持静脉穿刺点与血袋的落差,保持血流通畅。
嘱献血者做握拳和松手动作,以促进静脉回流。
血流不畅时,及时调整针头位置。
当不易观察血流时,应注意观察穿刺部位有无异常及血袋重量是否递增。

2.9.4血液开始流入采血袋后,即将其与抗凝剂轻匀混合。
宜采用连续混合采血仪。
如果采用手工混合,应当至少每90秒混合1次,充分混匀。
2.9.5应当对采血时间进行控制。
200ml全血采集时间>5分钟,或400ml全血采集时间>10分钟,应给予特殊标识,所采集的全血不可用于制备血小板。
200ml全血采集时间>7分钟,或400ml全血采集时间>13分钟,所采集的全血不可用于制备新鲜冰冻血浆。
2.9.6与献血者进行交流,观察献血者面容、表情,及时发现并处置献血不良反应。

2.10采血结束和献血者休息与观察2.10.1采血量达到要求时,嘱献血者松拳,松开止血带,合闭止流夹,用创可贴/消毒棉球/纱布轻按静脉穿刺点,拨出针头后即加重按压,用弹力绷带包扎,松紧度适中。
2.10.2嘱献血者在献血者休息处用茶点,休息10~15分钟。

2.10.3如出现献血不良反应,按相应程序处理。
2.11献血后注意事项的告知2.11.1应当印制献血后注意事项,并将其发给每位献血者。
2.11.2献血后注意事项主要有:1)穿刺点上的敷料应保留至少4小时,2)多补充水分,食用易消化的食物和水果,避免饮酒,保证充足的睡眠,3)献血后24小时内不剧烈运动、高空作业和过度疲劳,4)血站的联系方式,如果存在献血前没有如实告知的可能影响血液安全的高危行为,或者献血后感觉明显不适或异常,请其及时联系血站工作人员。

2.12致谢发给献血者无偿献血证和纪念品,表示感谢,鼓励定期献血。

2.13留取标本2.13.1检测结果用于判定血液能否放行的标本只能在献血时同步留取,不得在献血者健康检查时提前留取。
2.13.2如果使用带留样袋的采血袋,将留样针插入真空采血管,留取血样。
2.13.3如果使用不带留样袋的采血袋,将静脉穿刺针插入真空采血管,留取血样。
应单手操作,避免手被针头刺伤。

2.13.4将标本管内促凝剂或抗凝剂与血液充分混匀。

2.14血袋及血液标本标识2.14.1一次只能对来源于同一献血者的一份血袋、标本管和献血记录进行标识。

经核对后,将唯一性条形码标识牢固粘贴在采血袋、标本管、转移袋、血袋导管、献血记录单上。
2.14.2宜在标本管与留样针/静脉穿刺针分离前开始标识,对采血袋和标本管的标识应当首先连续完成,不应中断。
2.14.3宜在标本管与留样针/静脉穿刺针分离前核查采血袋、血液标本、献血登记表,所标识的献血条形码应一致。
宜采用计算机程序进行核查。
2.15热合2.15.1分段热合血袋导管,以供交叉配血、血型复查和血液标本保存使用。
血袋应保留注满全血的导管至少20 cm。
2.15.2在热合过程中不应用力牵拉或扭转导管,待焊极松开1~2秒后方可取出已封口的导管。

2.15.3应检查热合部位,如有渗漏,则重新热合,并评估对血液无菌性的影响。

2.15.4热合分离针头,将其放置在利器盒内。
2.16血液保存2.16.1全血采集后应尽快在规定的温度下保存。
2.17血液标本处理和保存2.17.1血液标本采集后应尽快处理,在规定的温度下保存。
2.17.2核酸检测标本应按要求进行离心、保存。
2.18献血现场整理2.18.1献血相关信息应及时录入BMIS。
2.18.2盘点采集血液、标本、献血登记表数量,应当一一对应,保证准确无误。
2.18.3做好血液装箱、运输和交接工作。
2.18.4盘点物料消耗。
2.18.5做好医疗废物装箱、运输和交接工作。
2.18.6整理清洁现场,用消毒剂擦拭操作台及采血器材,清洁地面。
3血液成分制备3.1血液成分品种3.1.1血液成分品种符合国家有关全血及成分血质量要求。
3.2制备环境3.2.1制备环境应当卫生整洁,定期消毒。

3.2.2应尽可能以密闭系统制备血液成分。
3.2.3用于制备血液成分的开放系统,制备室环境应达到10000级、操作台局部应达到100级(或在超净台中进行)。
3.2.4制备需要冷藏的血液成分时,应尽可能缩短室温下的制备时间。

3.3设备3.3.1设备数量及功能应能满足制备工作的要求。
3.3.2应建立和实施设备的确认、维护、校准和持续监控等管理制度,实施唯一性标识及使用状态标识,以确保设备符合预期使用要求。

3.4物料3.4.1物料应能满足制备工作的需要。
3.4.2物料质量及其生产和供应方的资质应符合相关法规的要求。
3.4.3物料使用前,应检查有效期、外观质量等,确认符合质量要求后方可使用。

对不合格物料应进行标识、隔离,防止误用。
3.4.4制备方法制备新品种的血液成分或制备条件发生明显改变时,应对血液制备方法进行确认。
3.5起始血液3.5.1用于制备血液成分的起始血液应符合国家有关全血及成分血质量要求。

3.5.2起始血液的保存和运输应当符合国家有关规定的要求。
3.5.3接收起始血液时,应核对数量,检查外观、血袋标签等内容,确认符合质量要求后方可用于血液成分制备。
3.6制备方法3.6.1离心3.6.1.1根据所制备血液成分要求和离心机操作手册,确定离心转速、加速和减速、离心时间和温度等参数,编制离心程序。
3.6.1.2制备血小板、粒细胞的离心温度为22±2℃。

3.6.1.3制备其他血液成分的离心温度为4±2℃。

3.6.1.4离心程序应经过确认,应能分离出符合质量要求的血液成分。
3.6.1.5对已经投入常规使用的离心程序的变更实施控制,定期检查核对,防止被非授权修改。

3.6.1.6每批血液制备的离心记录应包括离心操作者签名和所采用的离心程序。

3.6.2分离3.6.2.1离心结束后,从离心机中取出离心杯,从离心杯中取出血袋,避免振动,进行目视检查,观察离心效果、血袋及其导管有无渗漏,离心杯中有无血迹,如有破损应查找渗漏点。

血袋破漏的,应作消毒和报废处理。
3.6.2.2将血袋置于分浆夹或血液分离机。
将不同分层的血液成分转移至密闭系统的转移联袋中,以更大限度收集目的成分(红细胞、血小板、血浆等),并且使不需要的其他成分的残留量更小的方式进行分离和转移。
3.6.3速冻3.6.3.1速冻是保存凝血因子Ⅷ的关键加工步骤,冷冻速率和血浆中心温度是2个关键参数。
3.6.3.2应当使用专用设备,按操作说明书进行冷冻操作。
3.6.3.3应当将拟速冻的血袋逐袋平放,而不应重叠堆放。
3.6.3.4应当将新鲜冰冻血浆和冷沉淀凝血因子快速冻结,更好在60 分钟内将血浆中心温度降至-30℃以下。
3.7标识3.7.1使用联袋制备时,在原袋和转移袋分离之前,应当检查每个血袋上献血条码的一致性。
宜采用计算机系统进行核对,以避免人为差错。

3.7.2需要连接新的血袋(过滤、分装等)时,应当保证每一血袋献血条码一致。
宜采用按需打印方式产生标签,粘贴完毕,经计算机系统核对无误后,才给予断离。
3.7.3应当对血液制备过程中发现的疑似不符合品进行标识和隔离,以进一步调查和判断。
3.8目视检查3.8.1在接收、离心、分离、热合及交付的各个环节应对每袋血液进行目视检查。
3.8.2目视检查内容主要有:是否有渗漏、标签是否完整、血液外观是否正常。
3.8.3目视检查发现异常的,应给予标识、隔离及进一步处理。
3.9质量记录3.9.1制备记录主要有:血液交接、制备,设备使用与维护,制备环境控制,医疗废物处理等。
3.9.2制备记录应可追溯到起始血液、制备人员、制备方法、制备环境、使用设备和物料。

3.9.3制备记录宜以电子记录为主,以手工纸面记录为补充。
3.10全血分离制备血液成分3.10.1多联袋制备血液成分。
3.10.1.1红细胞和冰冻血浆的制备1)第1次重离心后将尽可能多的血浆转移至转移袋,2)将红细胞保存液袋内的红细胞保存液转移至红细胞袋,充分混合即为悬浮红细胞,3)核对血袋上的献血条形码,如一致则热合断离,生成1袋悬浮红细胞和1袋血浆,4)血浆红细胞混入量少(目视观察)即可将血浆袋热合断离,5)如血浆红细胞混入量较多,应当经过第2次重离心后,把上清血浆转移至已移空的红细胞保存液袋,热合断离(如欲制备冷沉淀凝血因子,则不热合断离),6)将血浆速冻,低温保存。
3.10.1.2红细胞、浓缩血小板和冰冻血浆的制备(富血小板血浆法):1)第1次轻离心后将富含血小板血浆转移至转移袋,2)将红细胞保存液袋内的红细胞保存液转移至红细胞袋,3)核对血袋上的献血条形码,如一致则热合断离,生成1袋悬浮红细胞和1袋富血小板血浆,4)将富含血小板血浆袋重离心,上清为血浆,沉淀物为血小板,5)留取适量血浆,将多余的血浆转移至已经移空的红细胞保存液袋,热合断离,生成1袋浓缩血小板和1袋血浆,6)将血浆袋速冻,低温保存,7)将浓缩血小板袋在室温静置1~2小时,待自然解聚后,轻轻均匀血袋,制成浓缩血小板混悬液,在22±2℃的环境下振荡保存。
3.10.1.3红细胞、浓缩血小板和冰冻血浆的制备(白膜法):1)第1次重离心后,将血浆转移至第1个转移袋,将适量血浆及白膜层转移至第2个转移袋,2)将红细胞保存液袋内的红细胞保存液转移至红细胞袋,充分混合即为悬浮红细胞,3)核对血袋上的献血条形码,如一致则热合断离悬浮红细胞袋和血浆袋,4)将白膜成分袋和1个空袋一起进行轻离心,将富含血小板血浆(上层)转移至空袋,制成浓缩血小板,热合断离,弃去白细胞袋。
3.10.2冷沉淀凝血因子制备3.10.2.1用于制备冷沉淀凝血因子的起始血液为新鲜冰冻血浆。
3.10.2.2离心法3.10.2.2.1取出待制备冷沉淀的新鲜冰冻血浆,置4±2℃冰箱中过夜融化或在4±2℃水浴装置中融化。
3.10.2.2.2当血浆基本融化时,取出血浆,在4±2℃的环境下重离心。
3.10.2.2.3将大部分上层血浆移至空袋,制成冰冻血浆。

将留下的20~30ml血浆与沉淀物混合,制成冷沉淀凝血因子。
3.10.2.3虹吸法3.10.2.3.1将新鲜冰冻血浆袋(A袋)置于4±2℃水浴装置中,另一空袋(B袋)悬于水浴箱外,位置低于血浆袋,两袋之间形成一定的高度落差。
3.10.2.3.2血浆融化后,随时被虹吸至B袋中,当融化至剩下40~50 ml血浆与沉淀物时,闭合导管,阻断虹吸。
将血浆与沉淀物混合,制成冷沉淀凝血因子(A袋)。
将A袋和B袋(冰冻血浆)热合断离。
3.10.3洗涤红细胞制备3.10.3.1待用洗涤溶液联袋提前放置冷藏保存,无破损渗漏,溶液外观正常,在有效期内。
3.10.3.2将合格的红细胞悬液用作制备洗涤红细胞悬液的起始血液,无破损渗漏,血液外观正常,在有效期内。
3.10.3.3使用无菌接合机将待洗涤的红细胞悬液袋导管和洗涤溶液联袋进行无菌接合连通。
3.10.3.4将洗涤溶液移至红细胞袋内,每单位红细胞(1个单位红细胞是指200ml全血制备的红细胞)中加入的液体量约为100ml,夹紧导管,混匀。
3.10.3.5按照制备红细胞的离心程序进行离心操作。
3.10.3.6离心后将血袋取出,避免震荡,垂直放入分浆夹中,把上清液转移至空袋内,夹紧导管。
3.10.3.7重复3.10.4~3.10.6步骤,洗涤3次。
3.10.3.8将适量(每单位红细胞中加入约50 ml)保存液(生理盐水或红细胞保存液)移入已完成洗涤的红细胞,混匀。
3.10.3.9热合,贴签,入库。
3.10.3.10如果是在开放环境制备,应严格遵从无菌操作。
3.10.3.11如果在开放环境制备或更后以生理盐水混悬,洗涤红细胞保存期为24小时。
如果是在闭合无菌环境中制备且更后以红细胞保存液混悬,洗涤红细胞保存期与洗涤前的红细胞悬液相同。
3.10.4去除白细胞3.10.4.1应当使用白细胞过滤技术去除全血或红细胞悬液中的白细胞。
3.10.4.2根据白细胞过滤器生产方说明书的要求进行过滤操作。
3.10.4.3应当在密闭环境(使用白细胞过滤多联血袋或无菌接合技术)制备。
3.10.4.4应当在采血后2天内(采血次日为第1天)完成白细胞过滤。
3.10.4.5检查待滤过血液的外观,并充分混匀后进行过滤。
3.10.4.6如果在进行白细胞过滤操作前,血液已经处于保存温度(4±2℃),需要在室温进行过滤时,室温应18℃~25℃,而且应当尽快放回至既定保存温度的环境中,从取出到放回的时间应<3小时。
3.10.4.7如果在白细胞过滤后,将血液转移至不属于原联体血袋的其他血袋,应当建立与实施标识控制机制,保证过滤后血液的正确标识。
3.10.5冰冻红细胞3.10.5.1红细胞甘油化3.10.5.1.1取拟冰冻保存的全血或悬浮红细胞,离心去除上清液,用无菌接合技术将红细胞转移至容量适当的、适宜于冰冻保存的转移袋内。
3.10.5.1.2在无菌条件下,缓慢滴加复方甘油溶液至红细胞袋内,边加边振荡,使其充分混匀。
3.10.5.1.3在室温中静置平衡30 分钟,置-65℃以下保存。

3.10.5.2冰冻红细胞的解冻从低温冷冻保存箱中取出冰冻红细胞,立即放入37℃~40℃恒温水浴箱中,轻轻振动使其快速融化,直至冰冻红细胞完全解冻。
3.10.5.3洗涤除去甘油 将专用洗涤盐液袋与解冻红细胞袋无菌接合,采取渗透压梯度递减方法洗涤。

更后1次的洗涤上清液应无明显溶血迹象。
3.10.5.4使用自动化设备制备冰冻和解冻红细胞时,按照设备使用说明书进行操作。
3.10.6血浆病毒灭活 (亚甲蓝光化学法)3.10.6.1根据设备操作说明书设置医用血浆病毒灭活光照柜的参数。
3.10.6.2根据血浆的规格选择相应病毒灭活血袋。

3.10.6.3用无菌导管连接设备或百级净化台内按无菌操作技术将血浆袋与病毒灭活血袋连接。
3.10.6.4将血袋悬挂于支架上,打开导管夹,使血浆经“亚甲蓝添加元件”,流入光照袋。
3.10.6.5在医用血浆病毒灭活光照柜中进行光照。

3.10.6.6光照处理后的血浆经病毒灭活装置配套用输血过滤器过滤,滤除亚甲蓝和绝大部分白细胞,即得病毒灭活血浆。

3.10.7血液辐照3.10.7.1辐照室应符合国家有关电离辐射防护与辐射源安全标准的要求。
3.10.7.2按照辐照仪使用说明书设置辐照参数。

3.10.7.3血液辐照更低剂量为25 戈瑞(Gy),血液任何位点的辐照剂量不宜超过50 Gy。
3.10.7.4红细胞在采集后14天内可辐照,辐照后可再储存14天。
3.10.7.5血小板在保存期内均可辐照,辐照后可保存至从采集算起的正常保存期限。

3.10.7.6粒细胞宜在采集后尽快辐照,辐照后宜尽快输注。
3.10.7.7在辐照过程中应严格区分未辐照和已辐照血液的标识。
3.10.7.8冰冻解冻去甘油红细胞和血浆不需辐照处理。
4血液检测4.1输血相关传染病的检测项目及检测方法4.1.1检测项目4.1.1.1人类免疫缺陷病毒(HIV)感染标志物,包括:(1)人类免疫缺陷病毒核酸(HIV RNA),(2)人类免疫缺陷病毒1型抗体(抗HIV-1)和人类免疫缺陷病毒2型抗体(抗HIV-2),或者抗HIV-
1、抗HIV-2和p24抗原(HIV Ag/Ab)。
4.1.1.2 乙型肝炎病毒(HBV)感染标志物,包括:(1)乙型肝炎病毒核酸(HBV DNA),(2)乙型肝炎病毒表面抗原(HBsAg)。
4.1.1.3丙型肝炎病毒(HCV)感染标志物,包括:(1)丙型肝炎病毒核酸(HCV RNA),(2)丙型肝炎病毒抗体(抗HCV),或者HCV抗原和抗体(HCV Ag/Ab)。

4.1.1.4 梅毒螺旋体感染标志物:梅毒螺旋体特异性抗体(抗TP)。

4.1.1.5 丙氨酸氨基转移酶(ALT)。

4.1.1.6 国家和省级卫生计生行政部门规定的地方性、时限性输血相关传染病标志物。
4.1.2 检测方法4.1.2.1 检测方法包括:(1)核酸扩增检测技术,包括转录介导的核酸扩增检测技术(TMA)、实时荧光聚合酶链反应(PCR),(2)血清学检测技术,包括酶联免疫吸附试验(ELISA)、化学发光免疫分析试验(CLIA)。

(3)速率法(湿化学法)。

4.1.2.2 检测策略(1)实施核酸检测试剂批签发之前,HIV、HBV和HCV感染标志物应采用2遍血清学检测和1遍核酸检测,血清学检测应采用2个不同生产厂家的试剂,实施核酸检测试剂批签发之后,HIV、HBV和HCV感染标志物应采用核酸和血清学检测2种方法各进行1次检测。
对于酶免检测阳性的标本可不再进行核酸检测,直接视为该项目检测结果不合格。
(2)梅毒螺旋体感染标志物采用2个不同生产厂家的血清学检测试剂进行检测。
(3) ALT采用速率法(湿化学法)进行1次检测。
4.2血液检测试剂4.2.1试剂选择4.2.1.1必须选择经国家食品药品监督管理部门批准用于血源筛查的体外诊断试剂。
4.2.1.2血站实验室应建立血液检测试剂的评价、选择和确认程序,可自行开展试剂评价(见附录B),也可充分利用国家或省级专业机构的评价数据。

4.2.2证照要求4.2.2.1应建立血液检测试剂证照审核程序,在采购前和验收时核实应具备的有效证照文件。
4.2.2.2采购药品类检测试剂应索取以下加盖供货单位印章的资料存档:(1)《药品生产许可证》或者《药品经营许可证》和营业执照复印件,(2)《药品生产质量管理规范》或者《药品经营质量管理规范》认证证书复印件,(3)药品的批准证明文件复印件,(4)供货单位药品销售委托书,(5)销售人员有效身份证明复印件,(6)血源筛查体外诊断试剂的批签发文件,(7)出厂质量检验报告等。
4.2.2.3采购医疗器械类检测试剂应索取以下加盖供货单位印章的资料存档:(1)《医疗器械生产许可证》、《医疗器械经营许可证》、第二类医疗器械经营备案凭证、第一类医疗器械生产备案凭证、营业执照复印件,(2)医疗器械注册证或者第一类医疗器械备案凭证复印件,(3)供货单位医疗器械销售委托书,(4)销售人员有效身份证明复印件,(5)出厂质量检验报告等。
4.2.3进货检查验收应建立并执行进货检查验收制度,检查验收内容主要有:(1)验明药品合格证明和其他标识,(2)外观检查(运输包装箱完整无损,运输冷链符合要求,试剂包装盒完整无损,无液体泄漏),(3)到货数量和销售凭证(购货单位、试剂、供货商等名称,规格、批号、数量、价格),(4)医疗器械采购、验收、存储、使用管理应符合《医疗器械管理条例》有关规定。
隔离存放应将通过进货检查验收的试剂进行隔离存放,防止误用。
4.2.5质量抽检4.2.5.1应建立并执行试剂的质量抽检制度,应对每次购进的试剂进行质量抽检。
4.2.5.2应将试剂说明书列入文件控制范围。
应对试剂说明书版本和内容进行检查。
其操作要求如已变更,实验室的试验操作在试剂启用时应同时变更,严格控制未按试剂说明书进行试验操作的情形发生。
4.2.5.3试剂盒组成、组分性状与说明书一致,无泄漏,足量,标识正确。
4.2.5.4用于质量抽检的标本有:1)试剂盒对照,2)室内质控品,3)实验室自制或商品化的血清盘。
前2种为必须,后1种为可选。
4.2.5.5质量抽检结果要求:1)试剂盒对照品检测结果符合试剂说明书要求,2)室内质控品检测结果符合既定要求,3)如果适用,实验室自制或商品化的血清盘检测结果符合既定要求。
4.2.5.6实验室核酸检测用标本汇集管、核酸提取纯化和扩增检测使用的消耗品原则上应由核酸检测试剂厂商配套提供。
4.2.6审核批准4.2.6.1应由授权人对采购验收和质量抽检的过程和结果进行审核,批准其用于血液检测。
4.2.6.2应建立和保存试剂采购验收、质量抽检和审核批准的记录(见附录C)。
4.2.7试剂保存和质量监控4.2.7.1应对经批准使用的试剂进行标识和放行。
4.2.7.2应按试剂说明书要求的保存条件进行保存,应在有效期内使用。
4.2.7.3应对试剂的库存(批号、失效期、库存量等)进行管理,防止试剂过期或者中断。
4.2.7.4核酸检测试剂和耗材应保存在试剂耗材储存和准备区。
经过质检后的试剂,应将试剂盒内的阳性对照和质控品放置于标本处理区的冰箱内。
4.2.7.5在试剂保存和使用过程中应注意试剂性能出现衰减,如果试剂盒对照品和室内质控品的检测值呈现连续走低趋势且无法使其回升纠正,应考虑终止使用。
4.3仪器设备使用要求4.3.1新的或者经过维修后可能影响检测结果的检测设备在正式投入正常使用之前应经过确认。

新设备的确认应包括安装确认、运行确认和性能确认。
经过大修的设备根据需要进行适当确认,必要时应进行计量检定或校准。
核酸检测系统正式投入使用之前,还应进行分析灵敏度验证。
4.3.2按照检测设备用户手册要求进行操作,包括使用、校准、维护等工作。
4.3.3如果使用多台设备检测同一个项目,应对设备之间的性能和差异进行比较。
4.3.4应定期检查自动化检测设备试验参数的设置,应保存检查记录。
4.3.5在试验过程中自动化检测设备出现故障需要进行手工操作时,应注意自动化设备操作和手工操作的衔接及其对结果的影响。

应记录手工操作步骤和操作者。

4.4实验室信息管理系统4.4.1应使用实验室信息管理系统对整个检测过程(从标本接收、试验、结果和结论判定)进行信息化管理。

4.4.2实验室信息管理系统的功能应包括:1)标本接收,2)试验项目选择,3)试验数据记录与汇总,4)试验数据的计算,5)试验结果的判定,6)血液检测结论的判定,7)血液检测结论传输至BMIS并为其所利用。
4.4.3实验室信息管理系统运行参数的设置应建立权限控制。
应保存设置参数的书面记录,并定期将其与实际设置参数对照,确保设置无误,应保存核实记录。
4.4.4 集中化检测实验室和委托其开展核酸检测实验室的信息管理系统宜具备实验室间标本信息传递、检测结果反馈和结果利用的功能。

4.5核酸检测实验室防污染控制4.5.1 核酸检测实验室分区及功能要求。
原则上可以设置3个独立的工作区域: 试剂耗材储存与准备区、标本处理和标本制备区(核酸纯化)、扩增检测区,各区域空间完全相互独立,不能直接相通。
其中试剂耗材储存与准备区必须独立设置,如果单机检测设备可以实现混样、核酸纯化、扩增检测中的两项或多项功能,相关区域可以根据设备功能进行相应合并。
4.5.2 核酸检测实验室通风系统。
实验室实施空气流向控制,扩增前和扩增后区域应具有独立通风系统,扩增后区域保持负压状态,其它区域保持正压或常压状态,防止扩增产物进入扩增前的区域。
4.5.3 核酸检测实验室的清洁、消毒及环境监控。
核酸检测实验室应具有清洁、消毒设施,在试验结束后对实验室地面、实验台面和空气实施清洁和消毒。
消毒时应使用各区域专用的清洁用具,遵循从清洁区域向污染区域实施消毒的原则,防止交叉污染。
4.5.4 核酸检测实验室污染的控制。
4.5.4.1单向工作流向制度。
标本接收区域应与核酸实验室区域分开,防止过多人员进入标本处理区域造成污染。
实验室人员和物品的工作流向应为试剂耗材储存与准备区、标本处理和标本制备区(核酸纯化)、扩增检测区,不得逆向流动。
4.5.4.2防止实验室核酸扩增产物污染和交叉污染的措施。

严格执行实验室分区制度,各区域只用于特定的操作,不得从事其它工作,各区域的试剂、仪器、设备及各种物品包括试验记录、标记笔等均为该区专用,不得交叉使用。
4.6血液检测标本4.6.1血液标本的一般要求 1)标本与血液、献血者一一对应,2)标本质量符合检测项目技术要求,3)标本信息具有可追溯性。

4.6.2血液标本采集与送检程序的制定4.6.2.1血站实验室应与血液标本采集和送检部门进行充分沟通与协商,共同制定标本采集和送检程序,质量管理部门应予以审核。
4.6.2.2血液集中化检测的委托方和受托方应进行充分沟通与协商,共同制定标本采集和送检程序,双方质量管理部门应予以审核,并经双方法定代表人批准。
4.6.2.3标本采集和送检程序的要点有:(1)标本类型及检测项目、标本量、标本管、标本运输及包装要求,(2)标本的唯一性标识(条形码),(3)标本的质量要求,(4)标本采集、送检和接收,(5)标本信息和检测报告信息的传输与接收,检测报告时限,(6)如为集中化检测,检测的委托方和受托方的标识与联系方式。
4.6.3血液标本管的选择4.6.3.1应根据每项试验的技术要求,采用相应类型的真空采血管留取检测标本。
试管应无裂痕、无渗漏,容量应满足检测项目要求。
核酸检测标本管应使用无菌、无DNA酶、无RNA酶的真空采血管,宜采用含惰性分离胶的乙二胺四乙酸二钾(EDTA-K2)抗凝真空采血管。
采血管的保存温度应不高于25?C。
标本因运输或检测频次等原因不能在72小时内完成检测时,标本需要进行冷冻保存,冷冻保存的采血管应经过性能验证,包括采血管材质耐低温性能、惰性分离胶耐低温性能。
4.6.4血液标本的采集与标识4.6.4.1应对血液标本采集前的准备、标本的采集、标识、登记和保存过程实施有效控制,一次只对一袋血液和同源血液标本管贴签,确保标本与血液、献血者一一对应,贴签无误。
标本质量符合检测项目技术要求。
4.6.4.2检测结果用于血液放行的血液标本,应在采集血袋血液的同时或者从血袋血液中留取。
4.6.4.3血液标本的采集与标识的具体操作见本规程第2章全血采集。
4.6.5血液标本采集后的处理4.6.5.1可以电子或书面方式登记标本信息,应进行核对,防止信息录入错误。
可通过网络、传真或其它形式传输标本信息。
4.6.5.2核酸检测标本采集后,应在4小时内离心,分离细胞和血浆。
如不能按上述要求处理采集的标本,应对所采集标本的处理方式进行确认,应定期进行质量监控。
标本需要冰冻运输或保存的,宜采用水平离心机,以防止二次离心时胶面不平整发生断裂,离心后24小时内在-40?C~-18?C冻存。
4.6.5.3血液标本在采血现场的临时保存温度为2~8℃。
4.6.6血液标本包装与运输4.6.6.1标本应隔离密封包装,包装材料应满足防水、防破损、防外泄、保持温度、易于消毒处理。
装箱时应保持标本管口向上。

4.6.6.2对于送交集中化检测实验室的标本的包装要求主要有:1)可使标本在运输在过程中保持2~10℃,2)外包装有明确标识(放置朝向、易碎、生物危险)和交付接收双方的联系方式。
4.6.6.3标本应保持在2~10℃运输,应对运输过程的冷链效果进行确认并定期监测。
冰冻的样本运输温度应在-40?C~-10?C,如果运输时间不超过8小时的,可采用2?C~10?C运输,标本到达接收实验室后,应在72小时内完成检测,不可再次冻融。

运输包装应有标本固定的装置,保证标本管在运输过程中不破损。

4.6.6.4应对标本运输过程进行记录,其要点有:(1)启运时间、地点,(2)运抵时间、地点,(3)标本箱编号、标本类型、数量,(4)运输包装有无受损、有无泄漏,(5)运输时间2小时以上的应记录箱内温度,(6)标本交运人、承运人,(7)运输过程中发生的可能影响标本质量的意外事件及处理措施。
4.6.7 血液标本的交接4.6.7.1接收时标本应核查:(1)标本来源、数量、采集时间,(2)标本采集管使用正确与否,(3)标本是否满足既定的质量要求,(4)标本与送检单信息对应性和完整性。
4.6.7.2如发现溢漏应立即将尚存留的标本移出,对溢出标本管和原包装箱进行消毒并记录,必要时报告实验室负责人和送检单位。
4.6.7.3应拒收标本的情形有:(1)检测申请关键信息缺失或不符,(2)标本管上无标识或标识不清、不正确,(3)标本管选用错误,(4)标本量不足或被稀释,(5)不符合试剂说明书要求的情形。
4.6.7.4标本交接双方应在标本交接记录签名。
4.6.8 标本接收后的处理及保存4.6.8、 1核酸检测标本的开盖应在生物安全柜或正压环境中,或者全自动开盖系统中进行,自动开盖和手工开盖均应有防止标本交叉污染的措施。
4.6.8、 2 核酸检测标本加样(汇集)前和加样(汇集)后转移在2-8℃中保存。
用于血清学检测的标本,应于采样后1周内完成检测,用于核酸检测的标本应于采样后72小时内完成检测,因特殊情况不能在上述时限内完成检测的标本应在-20℃以下冻存。

冻存的标本应在2-8?C或18-25?C条件下复融。
完全复融后标本轻轻颠倒混匀3-5次,如有纤原析出,应在标本采集时的离心条件下进行再次离心,同时检查标本条码是否破损。
4.7试验操作4.7.1按照试剂生产方提供的试剂使用说明书进行操作。
4.7.2如需对个别试验参数进行修改,应进行确认。
4.7.3宜采用自动化检测设备进行标本和试剂加样以及试验过程。
4.7.4自动化设备运行参数的设置应建立权限控制。
应保存设置参数的书面记录,并定期将其与实际设置参数对照,确保设置无误,应保存核实记录。

4.7.5应保存自动化检测设备运行记录,并定期对运行状态进行审核。
4.7.6自动化检测设备运行时,如果需要人工辅助或干预,应对实施人工辅助或干预的人员、人工辅助或干预的时间和内容、与自动化检测设备运行的衔接等进行记录。

4.7.7如果是采用手工操作进行标本和试剂加样,应完整记录每一加样和操作步骤。
4.8试验性能监控4.8.1一般要求4.8.1.1在血液检测过程中,应对试验性能持续进行监控,以发现正在发生的任何性能变化,这些变化如果没有得到及时纠正,更终可能导致试验批次的失败,或者弱阳性标本的漏检。
4.8.1.2选择能够实时反映试验性能变化的参数进行试验性能监控。

这些参数包括:(1)试验对照的检测值,(2)质控品的检测值。

4.8.1.3 选择能够反映试验系统变化的参数进行试验系统监控。
包括:(1)血清学检测系统初、复试反应率及两者的比例(复试有反应性标本数/初次试验有反应性标本数)。
(2)核酸检测系统初筛阳性率(混检或联检阳性率)、鉴别阳性率、拆分阳性率等。
4.8.1.4用于实时监控试验性能的试验对照和质控品若由试剂厂商提供,其检测值应满足试剂说明书的有效性判定标准。
在此基础上,实验室应增加使用第三方提供的质控品(外部质控品)实时监控试验性能。

4.8.1.5 外部质控品可用于监控试验的有效性和稳定性。

其使用应满足以下要求:(1) 质控品以合适的基质进行稀释,(2) 日常使用前应对质控品的种类、规格、外观、批号和效期进行检查,(3) 应与血液检测标本在相同的检测条件下进行检测。

每个检测系统的每批次至少应包括1份(套)外部质控品,(4)外部质控品应为第三方提供的质控品,与试验对照(试剂盒提供)不可相互替代,(5) 质控品所含目标检测物的浓度应满足试验要求。
血清学检测标志物含量接近检测限(S/CO值为2~5),核酸检测标志物(弱阳性质控品)浓度建议为核酸检测系统更低检测限的2-5倍(更低检测限是指标本中可能被检出的病毒,通常指在常规的实验室条件下>95%的标本可被检出,一般以IU/ml表示),6) 用量值表示样品性质的质控品,其量值应具有溯源性。
4.8.2实验室可利用质控品的检测数据开展室内质控,监控试验有效性和稳定性,监测系统的趋势变化。
血清学检测和ALT检测室内质控方法参见附录D。
核酸检测质控品的检测结果应与预期检测结果相一致。
4.8.3实验室应当选择参加国家卫生计生委指定的血站参比实验室组织的实验室室间质量评价活动,频率每年不少于2次。
4.9试验结果的判定4.9.1试验结果判定规则应制定明确的试验有效性和标本试验结果判定规则,将其编写或设置成为计算机程序,对其编写、设置、修改和启用应进行控制,所有修改均应保存原版本,确保其具有可追溯性。
4.9.2试验有效的判定4.9.2.1应核查每批试验所使用的试剂、设备、试验过程、有无人工干预或其他非正常工作步骤出现等关键控制点,正确无误后方可对试验有效性进行判定。
4.9.2.2试剂盒各种试验对照的检测值符合试剂说明书的要求,是判定试验有效的更低要求。
4.9.2.3外部质控品的检测值作为试验有效性的判定依据时,其检测值应符合既定要求。
4.9.2.4外部质控品的检测值作为试验稳定性的监控指标时,其检测值应符合既定范围。
如果超出既定范围,按既定程序决定试验是否有效。
4.9.2.5如果采用人工判定,应详细记录每一判定依据,应双人核查。

4.9.2.6如果判定一批试验无效,则该批试验所有标本的检测结果均为无效。

4.9.3标本试验结果计算和判定判定试验有效后,按照试剂说明书的要求计算临界值和/或灰区。

根据标本检测值与临界值的比较结果,判定为标本检测结论为无反应性、有反应性或不确定。

4.9.4对基于PCR检测原理的核酸检测系统,应观察整体扩增曲线,对结果的有效性进行判定。

对非特异扩增曲线,应分析原因,必要时对该标本重新进行检测。
4.10检测流程及结果判定4.10.1血清学检测结果判定。

初次试验为有反应性的检测标本的后续处理有2种选择。
方案1:以同一试验对原血样(或从血袋导管重新取样)做双孔复试,如果双孔复试结果均为无反应性, 其初试有反应性可能由于假反应性或技术误差导致,检测结论为无反应性,血液可放行供临床使用,如果双孔复试结果中任何1孔为有反应性, 则检测结论为有反应性,对应的血液及由其制备的所有成分应隔离并报废,将血液标本转送相关实验室做进一步确证或补充试验(图4-1)。
方案2:不做重复试验,初次试验结论即为检测更终结论(图4-1)。
4.10.2核酸检测结果判定(图4-2)4.10.2.1采用单人份标本进行HBV/HCV/HIV 核酸联合检测。
检测结果为无反应性的,判定为核酸检测合格,检测结果为有反应性的,判定为核酸检测不合格。
对核酸检测不合格的标本,应进行HBV、HCV、HIV鉴别试验。
4.10.2.2 采用混合标本进行HBV/HCV/HIV核酸分项检测。
检测结果为无反应性的,判定为核酸检测合格,检测结果为有反应性的,应进行拆分检测。
拆分检测结果为无反应性的,判定为核酸检测合格,拆分检测结果为有反应性的,判定为核酸检测不合格。
对核酸检测不合格的标本,应明确给出具体阳性反应的项目。
4.10.2.3 采用单人份标本进行HBV/HCV/HIV 核酸分项检测。
检测结果为无反应性的,判定为核酸检测合格,检测结果为有反应性的,判定为核酸检测不合格。
对核酸检测不合格的标本,应明确给出具体阳性反应的项目。
4.10.3 不同检测模式的结果判定流程检测结论应将血清学检测结果和核酸检测结果相结合进行判定(图4-3)。
4.11血型检测4.11.1血型检测项目(1)ABO血型正反定型,(2)RhD血型定型。

4.11.2血型检测方法血型检测常用方法有平板法和微板法,血型鉴定常用试管法和微板法。
按照试剂说明书和现行《全国临床检验操作规程》的规定进行具体操作和质量控制。
附录E提供了建立微板法一般方法,可供实验室自行建立微板法时参考。
全自动化血型鉴定系统按照使用说明书进行操作,投入使用前应经过充分确认。
如有必要,可增加血型基因检测。
4.11.3血型检测结论4.11.3.1应当经过2次检测结果的比对,一致时才能做出血型检测更终结论。
4.11.3.2如果2次检测结果不一致,应当进行细致审慎调查,发现导致不一致的原因,正确无误加以解决。
4.12血液检测更终结论的判定4.12.1血液检测合格判定标准HIV、HBV、HCV、梅毒感染标志物检测的更终结论均为无反应性,ABO/RhD血型正确定型,ALT≤50U/L。
按4.1.1.6检测地方性、时限性输血相关传染病标志物时其更终检测结果均为无反应性。
4.12.2血液检测不合格的判定标准不符合4.12.1条规定的情形。
4.12.3应当建立和实施血液检测更终结论的计算机判定程序。

如果需要人工判定,应由双人复核。
4.13血液检测更终结论的报告和利用4.13.1血液检测更终结论是血液放行与否的重要依据。
只有检测合格的血液方可放行供临床使用,检测不合格的血液不得放行。

4.13.2血液检测更终结论应以电子数据传输,并为计算机血液放行控制程序直接利用。
4.13.3如果需要人工录入血液检测更终结论,或者需要人工放行,应由双人复核。
4.13.4血液集中化检测的委托方和受委托方应明确血液检测更终结论的报告和利用方式、职责与分工。
4.13.5发现血液检测更终结论报告有误,应迅速启动血液检测更终报告收回和血液收回程序。
5血液隔离与放行5.1血液隔离5.1.1应设立物理隔离的合格品区、隔离区和不合格品区,并有明显标识。
5.1.2待检测、制备等尚未被判定合格的血液和不合格的血液应被物理隔离,防止不合格血液的误发放。
5.1.3设施设备应卫生、整洁,并定期清洁。

5.1.4对血液隔离的贮存设备进行温度监控。
5.1.5进出血液隔离区域的血液应做好交接和记录,记录至少包括血型、品名、数量、时间、交接人及签名等。
5.2血液放行5.2.1经过培训考核的被授权人员才能承担放行工作,质量管理人员对血液的放行进行监控,并留有监控记录。
5.2.2确认合格血液5.2.2.1对检测不合格、外观不合格、异常采集和符合保密性弃血等的血液,应进行标识,并移入不合格品区。

5.2.2.2将检测报告中尚未更终判定结果的血液继续隔离并做好标识。
5.2.2.3确认检测合格及血液外观检查合格的血液。
5.2.3贴签5.2.3.1制定程序,确保对合格血液正确贴签。
5.2.3.2一次只对一袋血液贴签。
5.2.3.3合格血液或合格血液制备的每一种血液成分只能印制唯一的合格血液标签。
该合格血液标签印有唯一的条形码。
5.2.3.4需要复制唯一的合格血液标签,应由被授权者确认原先印制的合格血液标签已被销毁。

5.2.3.5通过唯一的条形码可以追溯到献血者、用血医院以及血液采集、检测、保存、发放等全过程记录。
5.2.3.6合格血液标签的内容符合《血站质量管理规范》的要求。
5.2.3.7粘贴标签前应检查确认血袋无破损、无渗漏,血液外观无异常。
5.2.3.8标签粘合胶应对血液质量无影响。
5.2.3.9 粘贴合格血液标签后应能清楚观察血液外观,并且不会影响血袋透气性。

5.2.3.10合格血液标签粘贴于血袋后应再次确认该标签粘贴无误。
5.2.3.11已粘贴合格血液标签的血液才能移入合格品区。
5.2.3.12已经放行进入合格品库的血液,再经制备、分装、转换后,应重新粘贴具有唯一性条形码的合格血液标签,并保证粘贴无误和可追溯性。
5.3计算机控制5.3.1 应采用计算机管理信息系统控制血液隔离与放行。
5.3.2 需要人工放行时,应建立与实施复核制度。

6质量控制6.1导则6.1.1范围质量控制包括全血及血液成分质量检查、关键物料质量检查、关键设备质量检查和环境卫生质量检查。
6.1.2抽样数量全血及血液成分和关键物料质量检查的抽样量为每月制备量的1%或至少4袋。
若该成分血每月制备量少于4袋的,在保证质量的前提之下,由血站自行制订抽样频率和数量。
6.1.3取样方法应当尽可能采用密闭系统进行取样。
如果采用开放系统取样,应当严格无菌操作。
取样对血液质量没有构成影响的,取样后的合格血液可发放使用。
6.1.4控制指标全血及血液成分的质量控制指标符合国家有关全血及成分血质量要求,关键物料、关键设备和环境卫生的质量控制指标遵从有关规定。
6.1.5检测机构血站可自行检测,也可委托具备相应检测能力的检测机构进行检测。
6.1.6趋势分析血站应当对血液质量控制抽检结果进行趋势分析,出现异常趋势时,应当组织有关部门实施调查和回顾,并采取相应的改进措施。

进行趋势分析时,应当充分考虑到献血者个体差异,对于由于献血者个体差异所引起的,而且在血液采集和制备过程中难以控制的不影响血液安全性的指标(见表6-1),如果有75%的抽检结果落在质量控制指标范围内,可认为血液采集和制备过程受控。
6.2血液质量控制6.2.1检查项目不同血液品种的质量控制检查项目见表6-
1、表6-1血液质量控制检查项目血液品种外观标签容量*无菌试验Hb*游离Hb*血细胞比容*保存期末溶血率*白细胞残留量*红细胞计数*血小板计数*血浆蛋白含量*上清液蛋白含量*pH*凝血因子Ⅷ活性*纤维蛋白原含量*甘油残留量*中性粒细胞计数*亚甲蓝残留量*全血√√√√√√去白细胞全血√√√√√√√浓缩红细胞√√√√√√去白细胞浓缩红细胞√√√√√√√悬浮红细胞√√√√√√√去白细胞悬浮红细胞√√√√√√√√洗涤红细胞(保存期同悬浮红细胞)√√√√√√√洗涤红细胞(保存期为24 h)√√√√√冰冻解冻去甘油红细胞√√√√√√√√浓缩血小板√√√√√√√单采血小板√√√√√√√√去白细胞单采血小板√√√√√√√√新鲜冰冻血浆√√√√√√病毒灭活新鲜冰冻血浆(亚甲蓝光化学法)√√√√√√√冰冻血浆√√√√√病毒灭活冰冻血浆(亚甲蓝光化学法)√√√√√√单采新鲜冰冻血浆√√√√√√冷沉淀凝血因子√√√√√√单采粒细胞√√√√√√注1:“√”为适用检查项目,注2:“ *”为适用于“75%的抽检结果落在质量控制指标范围内,可认为血液采集和制备过程受控”的检查项目6.2.2检查方法质量控制项目的具体试验方法见附录F。
6.3关键物料质量检查6.3.1一次性使用塑料采血袋质量检查6.3.1.1抽样:每批至少随机抽检5袋(套)。
6.3.1.2质量标准6.3.1.2.1产品标识:塑料采血袋标记产品名称、型式代号、采血袋(无采血袋时按转移袋)公称容量和国家标准编号组成。

塑料采血袋分为单袋(S),双联袋(D),三联袋(T),四联袋(Q)和转移袋(Tr)五种型式。
如符合国家标准要求,采血袋公称容量为400ml的双联袋(D)的产品标记为:血袋D-4006.3.1.2.2系统密闭性:塑料采血袋的采血针、采血管、输血插口必须连成一个完整的密闭系统,保证采集、分离、输注和储存血液时其内腔不与外界空气相接触。
6.3.1.2.3血袋袋体外观:塑料采血袋袋体应无色或微黄色,无明显杂质、斑点、气泡。
塑料采血袋内外表面应平整,在灭菌过程中和在温度不超过40℃的贮存期内不应有粘连。
塑料采血袋热合线应透明、均匀。
采血管和转移管内外表面光洁,不应有明显条纹、扭结和扁瘪。
袋中的抗凝保存液及添加液应无色或微黄色、无浑浊、无杂质、无沉淀。
6.3.1.2.4标签应字迹清楚,项目齐全。

标签应有下列内容:1)血液保存液的名称、配方和容量,2)公称容量(采血量),3)无菌有效期及不需通气的说明,4)“无菌”、“无热原”限定条件的说明,“一次性使用”、“用后销毁”字样,使用说明,保存的血液条件,5)注意事项:发现渗漏、长霉、混浊等变质现象,禁止使用,6)产品名称和标记,7)生产厂家名称、地址和商标,8)产品批号。
6.3.1.3检查方法:在光线明亮处,以目力检查,以挤压方式检查系统密闭性。
6.3.1.4物料检验报告所选用的血袋必须符合国家相关标准,每一批血袋必须有出厂检验报告。

6.3.1.5规格:必须符合使用要求。
6.3.1.6有效期:被检物料必须在有效期内。
6.3.2 一次性无菌注射器质量检查6.3.2.1抽样:每批至少随机抽检5支。
6.3.2.2质量标准6.3.2.2.1每个注射器的单包装上应有下列标志:1)生产厂家名称或商标,2)产品名称及规格,3)生产批号及有效期,4)一次性使用,5)包装如有破损禁止使用,6)若带注射针头,应注明规格,7)“无菌”、“无热原”字样。

6.3.2.2.2外观:注射器应清洁、无微粒和异物。
注射器外套必须有足够的透明度,能毫无困难地读出剂量,能清晰地看到基准线。
6.3.2.2.3润滑:注射器应有良好的润滑性能。
注射器的内表面(包括橡胶活塞),不得有明显可见的润滑剂汇聚。

6.3.2.3检查方法:在光线明亮处,以目力检查。
6.3.2.4物料检验报告所选用的注射器必须符合国家相关标准,每一批注射器必须有出厂检验报告。

6.3.2.5规格:必须符合使用要求。
6.3.2.6有效期:被检物料必须在有效期内。
6.3.3一次性使用去白细胞滤器质量检查6.3.3.1抽样:每批至少随机抽检5套。
6.3.3.2质量标准6.3.3.2.1外观:去白细胞滤器外壳应光洁,无明显机械杂质、异物,焊接面应均匀、无气泡,软管应柔软、透明、光洁,无明显机械杂质、异物、扭结。
6.3.3.2.2每个单包装上应有以下内容:1)产品名称、规格,2)使用符号或文字标明去白细胞滤器无菌、无热原,3)批号及失效日期,4)标明适用范围的产品标记,5)制造商和/或经销商名称、地址,6)单包装内不应有肉眼可见异物。

6.3.3.3检查方法:在光线明亮处,以目力检查。
6.3.3.4物料检验报告所选用的去白细胞滤器必须符合国家相关标准,每一批去白细胞滤器必须有出厂检验报告。
6.3.3.5规格:必须符合使用要求。
6.3.3.6有效期:被检物料必须在有效期内。

6.3.4一次性使用病毒灭活输血过滤器质量检查6.3.4.1抽样:每批至少随机抽检5套。
6.3.4.2质量标准6.3.4.2.1外观:病毒灭活输血过滤器的软管应光洁,无明显机械杂质、异物、扭结。
过滤部件、亚甲蓝添加元件外壳应光洁,无明显机械杂质、异物,焊接面应均匀、无气泡。
6.3.4.2.2每个单包装上应有以下内容:1)产品名称、规格,2)使用符号或文字标明病毒灭活输血过滤器无菌、无热原,3)批号及失效日期,4)标明适用范围的产品标记,5)制造商和/或经销商名称、地址,6)单包装内不应有肉眼可见异物。
6.3.4.3检查方法:在光线明亮处,以目力检查。
6.3.4.4物料检验报告所选用的病毒灭活输血过滤器必须符合国家相关标准,每一批病毒灭活输血过滤器必须有出厂检验报告。
6.3.4.5规格:必须符合使用要求。

6.3.4.6有效期:被检物料必须在有效期内。

6.3.5一次性单采耗材质量检查6.3.5.1抽样:每批至少随机抽检5套。
6.3.5.2质量标准6.3.5.2.1外观:包装完整,标识清晰。
6.3.5.2.2每个单包装上应有以下内容:1)产品名称、规格,2)使用符号或文字标明无菌、无热原,3)批号及失效日期,4)标明适用范围的产品标记,5)制造商和/或经销商名称、地址。

6.3.5.3检查方法:在光线明亮处,以目力检查。
6.3.5.4物料检验报告所选用的单采耗材必须符合国家相关标准,每一批单采耗材必须有出厂检验报告。
6.3.5.5规格:必须符合使用要求6.3.5.6有效期:被检物料必须在有效期内。
6.3.6血袋标签质量检查6.3.6.1抽样:每批至少随机抽检5张。
6.3.6.2质量标准标签的底色应为白色,标签应洁净、无破损,字迹清楚,标签上文字一般为实体黑色字体。
6.3.6.3检查方法:在光线明亮处,以目力检查。
6.3.6.4物料检验报告所选用的血袋标签必须符合国家相关标准,每一批血袋标签必须有出厂检验报告。
6.3.6.5规格:必须符合使用要求。
6.3.6.6拟采用新的供应方所提供的标签的确认方法参见附录G。
6.3.7硫酸铜溶液质量检查6.3.7.1抽样6.3.7.1.1自配硫酸铜溶液:每周检测一次。
6.3.7.1.2外购成品硫酸铜溶液:每批至少随机抽检5套。
6.3.7.2质量标准6.3.7.2.1自配硫酸铜溶液用于男性献血者血比重检查的硫酸铜溶液比重,在20℃时应为1.0520、允许误差为±0.0005、用于女性献血者血比重检查的硫酸铜溶液比重,在20℃时应为1.0510、允许误差为±0.0005、6.3.7.2.2外购成品硫酸铜溶液用于男性献血者血比重检查的硫酸铜溶液比重,在溶液允许的使用温度范围时应为1.0520、允许误差为±0.0005、用于女性献血者血比重检查的硫酸铜溶液比重,在溶液允许的使用温度范围时应为1.0510、允许误差为±0.0005、6.3.7.3检测方法:见现行的《中华人民共和国药典》附录中“韦氏比重秤法”。

6.3.7.4物料检验报告所选用的硫酸铜溶液必须符合国家相关标准,每一批外购硫酸铜溶液必须有出厂检验报告。

6.3.7.5规格:必须符合使用要求。
6.3.7.6有效期:被检物料必须在有效期内。
6.3.8真空采血管质量检查6.3.8.1抽样:每批至少随机抽检5支。
6.3.8.2质量标准试管上的标志、标签应清晰。
试管应无色透明、光滑、平整,正常视力能清楚观察到试管内血样,不得有明显变形、沙眼、气泡、杂质等。
6.3.8.3检查方法:在光线明亮处,以目力检查。

6.3.8.4物料检验报告所选用的真空采血管必须符合国家相关标准,每一批真空采血管必须有出厂检验报告。
6.3.8.5规格:必须符合使用要求。
6.3.8.6有效期:被检物料必须在有效期内。
6.3.9检验试剂质量检查6.3.9.1检验试剂包括:感染性标志物核酸检测试剂、乙型肝炎病毒表面抗原检测试剂、丙型肝炎病毒抗原/抗体检测试剂、艾滋病病毒抗原/抗体试剂盒、梅毒特异性抗体检测试剂、地方性时限性感染性疾病抗原/抗体检测试剂、丙氨酸氨基转移酶试剂盒、血型试剂盒、快速检测试剂盒等。
6.3.9.2检验报告对于血源筛查的体外诊断试剂盒,必须有国家批批检报告。
其他检测试剂试剂,以生产厂商出具的出厂检验报告为准。

6.3.9.3外观检查:每批抽检5盒试剂盒。
试剂盒包装应完整,标识清晰,试剂齐全无渗漏。
6.3.9.4运输要求试剂运送途中的温度必须符合试剂说明书要求,供应商必须提供试剂运输冷链监控温度记录。
6.3.9.5有效期:被检试剂必须在有效期内。

6.4关键设备质量检查6.4.1强制检定设备和校准设备必须定期对关键设备进行检定或校准,除国家强制检定设备外,其余设备血站可以依据国家计量检定规程,由经培训具有资质的质控人员自行进行,或委托相关计量机构/生产厂商进行。
6.4.2血站自行监测设备6.4.2.1成分制备大容量离心机质量检查6.4.2.1.1检查频率:每年监测1~2次,由血站自行或委托离心机厂商进行。
6.4.2.1.2 离心温度质量标准:规定温度±1℃。

检测方法:于离心机工作间隙,把经计量部门标定的温差电偶温度计的探头放入离心腔内,盖好离心机盖。
10分钟后观察离心机温度表显示的温度与温差电偶温度计显示温度的差值。
6.4.2.1.3离心时间质量标准:规定时间±20秒。

检测方法:使用秒表对离心机的时间控制进行检查。

把时间控制表调至规定时间,同时启动秒表,观察离心机时间控制表从开始计时到计时停止秒表所用的时间。
即为时间控制表按规定时间计时所用的实际时间。
6.4.2.1.4离心转速质量标准:规定转速±50r/分钟。

检测方法:打开离心机前面板,在连接离心转头轴上贴一张反光标签。
把转速控制调到规定转速值,然后启动离心机待转速稳定后,用转速仪的光束照明反光标签,观察转速仪显示屏上的转速值。
或采用其它适宜的方法检测。

注意事项:为保证检查人员的安全,检测时距转速仪的测量距离不得小于20cm。
6.4.2.2储血设备质量检查6.4.2.2.1检查频率:每月至少一次。
6.4.2.2.2温度质量标准: 储血设备的温度应在规定范围内,各储血设备的储存温度见下表。
储血设备温度标准设备种类温度(℃)储血冷藏箱(库)2~6血小板温箱(室)20~24低温冰箱(库)-25以下速冻冰箱-50以下超低温冰箱-65以下检测方法:使用经计量部门标定的温差电偶温度计(精确度为0.1℃)测定储血设备箱内的温度。
具体布点方式应当符合国家有关血液冷藏箱的要求。
6.4.2.2.3电源故障报警系统质量标准:电源发生故障时,报警系统应立即以声/光方式发出警报。
检测方法:切断储血设备的电源或开启报警测试按钮,模拟电源发生故障,此时报警系统以声/光方式发出警报。
或使用其它适宜的方法检测。
6.4.2.2.4温度失控报警系统质量标准:当储血设备的温度超出质量标准范围时,报警系统应以声/光方式发出报警。

检测方法:将储血设备的报警范围分别调至低于和高于储血设备温度时,报警系统应以声/光方式发出报警。
6.4.2.3压力蒸气灭菌器质量检查6.4.2.3.1检查频率:每周检查一次。
6.4.2.3.2检测方法和质量标准:可采用化学指示剂法或生物指示剂法进行灭菌效果监测,具体检测方法和质量标准应当符合国家有关消毒技术规范要求。
6.4.2.4采血秤质量检查6.4.2.4.1检查频率根据采血秤的使用频率制定相应检测频率,每半年至少一次。
6.4.2.4.2混匀器摇动频率质量标准:30~32次/分(进口采血秤见生产厂商说明书)。

检查方法:开启采血秤混匀器后,使用秒表计时,观察1分钟内混匀器摇动次数,摇动一个循环为一次。
6.4.2.4.3称量准确度质量标准:标示量±2%。

检查方法:开启采血秤,将标准砝码(模拟常规血液采集的重量)置于采血秤上,观察采血秤显示的数值。
6.4.2.4.4报警功能质量标准:采血袋中采血量到规定量时指示灯应闪光/蜂鸣器应发音报警。
检查方法:将标准砝码或经标准砝码标定的标准量模拟血袋置采血秤上时,采血秤的声或光提示报警应启动。
附录A献血者血红蛋白检测(硫酸铜目测法)A.1试验原理全血滴入标准硫酸铜溶液中,形成一层铜蛋白膜,包围在血滴外层。
观察全血在已知相对密度(比重)硫酸铜溶液中沉浮情况,可判定其相对密度(比重),从而确定其血红蛋白浓度。

A.2试剂A.2.1用于男性献血者(Hb≥120g/L)检测的硫酸铜溶液比重为1.0520、A.2.2用于女性献血者(Hb≥115g/L)检测的硫酸铜溶液比重为1.0510、A.2.3不同用途试剂瓶标识应便于区分A.2.4采用商品化硫酸铜试剂的,按试剂说明书规定的条件储存,在有效期内使用。
A.2.5硫酸铜溶液也可自行配制,配制方法见A.5、应保存配制记录。
A.2.6硫酸铜溶液比重随温度变化而变化的,温度每上升2℃,比重下降0.0005、在配制和使用时应注意这一特性。
A.2.7每瓶(50 ml)硫酸铜溶液的可用于检测25人次。
A.3标本要求A.3.1新鲜采集的末梢血或静脉血,抗凝或不抗凝血液均可使用。
A.3.2陈旧、溶血和严重乳糜的血液不可用来试验。
A.4操作步骤和结果判断A.4.1常规采集手指末梢血或静脉血。
A.4.2在距硫酸铜液面上方1cm处垂直将1滴血液轻轻滴入,血滴应不含气泡。
A.4.3在15秒内肉眼观察,判断结果:1)血滴很快下沉于瓶底,表明血液比重大于硫酸铜溶液比重,血红蛋白含量符合献血标准,2)血滴在硫酸铜溶液中部悬浮10 -15秒后下沉于瓶底,表明血液比重等于硫酸铜溶液比重,血红蛋白含量符合献血标准,3)血滴悬浮在硫酸铜溶液上部,15秒时不下沉,表明血液比重小于硫酸铜溶液比重,血红蛋白含量不符合献血标准。
A.4.4记录检测结果。
A.5硫酸铜溶液配制方法A.5.1贮存液(比重为1.1000)配制称取硫酸铜结晶(CuSO4?5H2O,分析纯)170.0g置于大试剂瓶中,在1000ml容量瓶中加入蒸镏水至刻度,测量此蒸镏水的温度,根据表A-1查出与温度相应的蒸镏水毫升数,不足的容量用滴定管补加入容量瓶中。

将容量瓶中蒸镏水全部倾入盛硫酸铜结晶的大试剂瓶中,再将容量瓶倒置2分钟,使蒸镏水全部滴入大试剂瓶中。

此时,容量瓶内尚附着蒸镏水约0.8ml,在计算时此容量已加在表内数字中。
摇动试剂瓶使硫酸铜完全溶解,即得比重为1.1000的贮存液。
如欲知所配制的贮存液比重是否准确,可用液体比重天平进行测定。
如配得的贮存液比重并非1.1000、比重每超过0.000
1、则在1000ml溶液中加入蒸镏水1ml。

例如,所配成的贮存液的比重1.1050、则在此溶液1000ml中加入蒸镏水50ml,即可校正其比重为1.1000、反之,如所配溶液的比重小于1.1000、则每少0.000
1、应在1000ml硫酸铜溶液中加入饱和硫酸铜溶液1ml。
在盛贮存液的试剂瓶上贴好标签,做好配制记录。
表A-1配制比重1.1000硫酸铜溶液需用蒸镏水的容量蒸镏水温度℃蒸镏水量(ml)蒸镏水温度℃蒸镏水量(ml)101003.6261006.5121003.8281007.0141004.0301007.7161004.3321008.3181004.7341008.9201005.1361009.6221005.5381010.4241006.0401011.2A.5.2工作液配制A.5.2.1配制100 ml不同比重工作液所需贮存液容量见表A-2、A.5.2.2确定工作液配制总量,量取所需量贮存液,加入容器内,慢慢加入蒸镏水至工作液总量,边加边摇匀,以消除硫酸铜溶液加水后容量缩减的影响。
配制时贮存液和蒸镏水的温度应相同,但不一定为25℃,10~40℃之间影响不大。
表A-2硫酸铜应用标准液配制比重贮存液用量(ml)比重贮存液用量(ml)比重贮存液用量(ml)1.035034.301.049048.201.063062.301.036035.301.050049.201.064063.351.037036.301.051050.201.065064.401.038037.251.052051.251.066065.401.039038.201.053052.251.067066.401.040039.201.054053.301.068067.401.041040.201.055054.301.069068.401.042041.201.056055.301.070069.401.043042.201.057056.301.071070.401.044043.201.058057.301.072071.451.045044.201.059058.301.073072.501.046045.201.060059.301.074073.501.047046.201.061060.301.075074.501.048047.201.062061.30A.5.2.3工作液配制后应检测其是否符合质量要求:1)测定比重是否准确,可用液体比重天平测定,必要时采用相对密度测定法,2)采用已知低于和高于献血者血红蛋白标准的全血进行检测,应符合预期要求。
A.5.2.4将配置完毕的工作液分装至小试剂瓶,粘贴标签。

A.5.2.5记录配制过程。
附录B血液检测方法的确认B.1总则本附录讨论了血站血液检测实验室采用一项新的检测方法,或更换现有检测方法时需要考虑的因素。
通常血液检测方法包括完成检测必需的仪器、试剂、校准品、试验程序组合。
检测方法必须由实验室选择。

必须按照生产商的说明书进行操作,确保检测结果符合实验室的要求。
血站对献血者及其捐献的血液进行强制性血液检测,包括输血相关感染病原学标志物检测、血型血清学检测和酶学检测。
方法学包括ELISA法、凝集法、速率法等,以及用于献血者采血前检查的快速诊断试验。
由于以上方法学原理的不同,方法确认的原则也不同。
依据当今国际公认的一些法规和指南,本附录提供了血站血液检测实验室常规使用的检测方法确认的原则和步骤,诣在提高血液检测实验室对检测方法确认的一致性和效率,确保检测方法变化的过程得到有效控制。
帮助用户满足文件和法规的要求。
B.2范围为血站血液检测实验室检测方法确认提供方案。
实验室需选择国家批准的符合国家要求的仪器、试剂盒或检测方法。
在新方法投入常规使用报告检测结果之前,需要就检测方法在实验室的使用性能进行确认。
不建议实验室对生产商提供的检测方法进行自行改动,如果确实需要修改,应与生产商合作进行新检测方法性能的评价测试,以确认修改后的系统在实验室的适用性和可靠性。
需确认的对象包括:实验室首次引入的检测方法,如实验室从未使用过的试剂、仪器等。
实验室首次将某项目引入现用检测方法,如HBsAg项目由A仪器检测改为由B仪器检测。
若多台仪器(相同品牌和型号)检测同一个项目,应对每一台仪器的性能进行确认比较。
B.3输血相关感染标志物检测方法的确认以下内容适用于酶联免疫吸附试验的确认。
快速诊断试验和确证试验等定性方法的确认可参照本章节内容。
B.3.1确认的一般要求B.3.1.1试验操作的培训开始确认新的检测方法之前,操作人员应当有充分的时间熟悉新系统,确定关键的操作步骤。

生产商应提供试剂或仪器的操作说明,试验原理,规格,试验步骤,局限性,质量控制和健康安全信息。
生产商应对操作者进行培训,确保操作人员正确操作。
B.3.1.2试剂的准备应选择经国家检定合格的病原学标志物诊断试剂。
严格遵从生产商的说明书进行操作。
对于正在进行确认的试剂,所有组份应来源于同一批试剂,不能由其他试剂所替代或实验室自己配制。
B.3.1.3仪器的准备应选择国家批准使用的检测仪器。
试验开始前,按要求对仪器进行维护校准。
对于开放试剂的仪器设备,特别注意试剂说明书要求的操作条件与仪器性能是否相适应。
如果仪器性能与试剂盒说明书的要求有差异,可以征得试剂生产商协助和同意,对本实验室仪器的试验操作参数进行修正,以达到试剂盒要求的试验状态。
B.3.1.4质量控制应建立有效的质量控制程序。
除直接采用生产商提供的质控品外,还应选择质量、来源稳定,无基质效应的质控品作为另外的室内质控物。

如可能,多试验方法比较过程中,应采用相同质控物。
一些定性试验每天只需要使用阴性和阳性质控物,而另一些定性试验可以产生量化的质控结果。
对此可以采用统计过程控制方法(SPC),用量化数据监控试验过程。
确认试验采用的标本不能等同于质控品使用。

试验过程中,应确保过程处于受控状态,否则必须重新试验。
B.3.1.5保持记录应记录和监控操作人员在试验过程中的健康安全,确保符合法律要求。
保留检测全过程的数据和结果,包括检测的速度和使用的适宜性等。
B.3.2重复性试验生产商提供的阴性阳性对照试验B.3.2.1.1试验程序:采用生产商提供的阴性、阳性对照,在不低于10天试验运行的前提下,进行至少20次检测。

B.3.2.1.2可接受标准:20次检测结果不能出现大于1次阴性阳性对照不符合生产商要求。
否则实验室必须终止试验,咨询试剂生产商,查找原因,采取纠正措施。

B.3.2.2方法精密性试验B.3.2.2.1试验程序:在定性试验中,如果能够产生量化试验结果(如ELISA试验),应采用接近临界值的标本,对精密度进行估计。
建议采用S/CO为2~4的标本,不适宜采用低值的阴性标本和高值阳性标本,因为此类标本距决定水平点即临界值(cutoff)的分析浓度相距较远。
B.3.2.2.2可接受标准:批内变异系数在15%以内,批间变异系数在20%以内。

B.3.3灵敏度及特异性试验本试验采用已知真实血清学状态的标本,经检测获得方法灵敏度和特异性方面的信息。
也可以将不同方法的灵敏性和特异性进行比较,得到量化的差异结果,判断是否具有统计学意义。
B.3.3.1标本的选择灵敏度和特异性试验通常对已知真实血清学状态的标本进行检测。
确定标本真实血清学状态可以采用金标准方法或临床诊断方法。
参考血清盘或能力验证(PT)的标本可用于本试验。
参考血清盘是指经过检测或经过与公认方法比较,或具有临床诊断意义的标本。
这些标本已经确立了真实的血清学状态,可追溯至经典方法或临床诊断结果。

可以从权威机构、专业研究机构和文献中获得参考血清盘的来源。
参考血清盘应包含具有不同分析物浓度的临床标本。
如可能,血清盘应包含对检测具有干扰的标本。
如可造成假阴性和假阳性结果的自身免疫性疾病、螺旋体疾病、白细胞抗体、风湿性关节炎、多发性骨髓瘤患者的标本。

尽管商品化参考血清盘在方法确认过程中,具有很好的时间和资源效率,但其局限性在于可能忽视了实验室目的检测人群中疾病的流行率和病原学因子抗原谱的分布。
因此,使用参考血清盘、能力验证标本结合常规实验室检测标本,可以提供更有意义、更可靠的确认结果。
PT材料可能存在基质干扰,对方法性能产生错误判断。
当PT材料为临界标本,或分子结构不同于天然血清,导致抗原决定簇不能被正常识别时,这种干扰尤其明显。
B.3.3.2标本的数量标本数量的估算,统计学中称为标本含量的估算依据试验设计的类型、结果变量的性质、研究目的和采用的统计分析方法而不同。
对于检测结果为计数资料的试验(如定性试验),一般而言,在试验误差控制较好的情况下,不同血清学状态的标本数量至少为30份。
否则可能影响试验的统计学功效。
B.3.3.3标本的保存应确保标本可用于常规检测并处于稳定状态,尽可能保持试验标本新鲜。
如需冻存,血清或血浆应保存在-20℃的条件下。

试验标本的保存状态、冻融次数、使用次数和时间应尽量一致,避免标本产生偏差。

如需要方法比较试验,应在相同时间进行,更大限度减小由于标本放置时间不同产生的结果差异。
B.3.3.4数据的收集和整理及时记录和检查所有试验数据,尽早发现系统和人为的误差。
如果能够确定一些结果是由于可知的差错造成,应详细记录差错原因,数据不能用于后续分析过程。

如果不能够确定产生异常结果的原因,在数据组中保留原始结果。
B.3.3.5数据的分析B.3.3.5.1单一检测方法灵敏性和特异性估计如果明确了每份检测标本真实的血清学状态,检测方法的灵敏度和特异性很容易计算。
表B-1为反映一个定性试验检测已知真实血清学状态标本的结果的2×2四格表资料。
通过这组数据可以计算被估计的灵敏度、特异性。
表B-1试验方法结果与诊断结果的2×2四格表诊断结果方法结果阳性阴性总计阳性ABA B阴性CDC D总计A CB DNB.3.3.5.1.1灵敏度和特异性估计灵敏度=100%〔A/(A C)〕估计特异性=100%〔D/(B D)〕灵敏度和特异性95%置信区间可通过二项分布计算。
B.3.3.5.2两方法灵敏度和特异性的比较可采用完全随机设计和配对设计试验,比较两检测方法的灵敏度和特异性。
完全随机设计时,可采用完全随机设计x2检验。
两方法采用不同的标本,标本相对独立。
这种情况下两方法灵敏度和特异性的比较实际是两样本率的比较。
配对设计时,可采用配对设计的McNemar x2检验。
两方法采用相同的标本,得到两个相关的灵敏度和特异性,这时注意当标本数较少时,需要计算校正x2或采用精确概率法检验。
详细计算见B.3.3.5.3、注意如果需要判断检测方法的准确性,单凭比较灵敏度和特异性是不够的。
除非一个方法的灵敏度和特异性均大于或小于另一方法,否则只能比较相同灵敏度时的特异性,或相同特异性时的灵敏度。
当灵敏性和特异性均不相同时,很难比较两方法准确性。

这时可采用受试者工作特征曲线法(ROC曲线法)进行比较。

该法是近年来公认的评价和比较检测方法准确度的较好方式。

该方法可以考虑检测方法在所有临界值时的灵敏度和特异性。

通过比较不同方法ROC曲线下的面积,确定和参考方法的特性。
鉴于此项内容不在本规程要求的范围,实验室人员如需要了解更多信息,可以查找相关资料。
如果需要量化两方法灵敏度和特异性之间差异,可以对灵敏度或特异性的差异进行估计。
以配对设计试验为例,两方法采用相同的标本进行检测的结果可以汇集成表B-2、如果两方法采用的标本不同,则不能采用表2的方式整理数据。
表B-2两方法结果和诊断结果的三项比较方法结果总标本数真实诊断结果方法1方法2阳性阴性阳性阳性a=a1 a2a1a2阳性阴性b=b1 b2b1b2阴性阳性c=c1 c2c1c2阴性阴性d=d1 d2d1d2总标本数Nn1n2B.3.3.5.2.1两方法灵敏度差异估计两方法灵敏度估计灵敏度1=100%[(a1 b1)/n1]灵敏度2=100%[(a1 c1)/n1]两方法灵敏度差异估计灵敏度1-灵敏度2=100%[(b1-b1)/n1]B.3.3.5.2.2两方法特异性差异估计两方法特异性估计特异性1=100%[(c2 d2)/n2]特异性2=100%[(b2 d2)/n2]两方法特异性差异估计特异性1-特异性2=100%[(c2-b2)/n2]B.3.3.5.3不同检测方法检测结果的统计分析通常采用配对设计四格表x2检验和Kappa检验评价两个定性检测方法性能的差异或一致性。
如果已知标本的血清学状态,或者已存在特设或隐含的金标准结果,可采用配对设计四格表x2检验中的McNemar x2检验评价两方法结果的不一致性,Kappa检验评价两方法结果的一致性。
如果未知标本的血清学状态,检测结果有序变量的档次划分也是相同的,也可以采用Kappa检验评价两种检测方法结果的一致性。
另外,两方法的符合性指标也能够量化两种检测方法结果的一致程度。
B.3.3.5.3.1配对设计四格表x2检验(McNemar x2检验):对于隐含金标准或特设金标准的2×2四格表资料,可采用McNemar x2检验,判断两种检测方法结果不一致部分是否具有统计学意义。
该法适用于标本含量适中的资料,因为本法仅仅考虑两检测方法不一致的情况,而未考虑两方法检测结果一致的情况。
当n很大,两方法一致率较高,不一致结果数量较小,即使McNemar x2检验具有统计学意义,但实际意义往往不大。

通常适用于b c≥40、注意当25≤b+c<40、采用McNemar检验分析配对设计四格表资料需作连续性校正。

若b c<25、应采用精确概率法检验。
B.3.3.5.3.2Kappa检验:Kappa统计量是Cohen1960年提出的一种校正机遇之后衡量两种检测方法一致性的指标。
Kappa(常缩写成K)值在-1到+1之间,如果K=-
1、说明两种检测方法检测的结果完全不一致,K=0、说明观察的一致性完全由偶然误差造成,K=
1、说明完全排除机遇一致性后的真正一致性。
一般对总体而言,若K>0.75、表明一致性为优,若K在0.4~0.75之间,表明一致性良好,若K<0.4、表明一致性较差。
B.3.3.5.3.3两种检测方法结果的符合性估计如果需要量化两方法检测结果的符合程度,可以对两方法检测结果的符合性进行估计。

方法2方法1阳性阴性总计阳性aba b阴性cdc d总计a cb dB.3.3.5.3.4符合性=100%[(a d)/n]B.4ALT检测方法的确认以下内容适用于ALT速率法确认。
其它定量检测方法确认可参照本规程。
B.4.1确认的一般要求B.4.1.1试验操作的培训开始确认新的检测方法之前,操作人员应当有充分的时间熟悉新系统,确定关键的操作步骤。
生产商应提供试剂或仪器的操作说明,试验原理,规格,试验步骤,局限性,质量控制和健康安全信息。
生产商应对操作者进行培训,确保操作人员正确操作被确认系统。

B.4.1.2试剂的准备应选择国家批准生产的ALT诊断试剂。

严格遵从生产商的说明书进行操作。
对于正在进行确认的试剂,所有组份应来源于同一批试剂,不能由其他试剂所替代或实验室自己配制。
B.4.1.3仪器的准备应选择国家批准使用的检测仪器。
试验开始前,按照要求对仪器进行校准。

校准品必须能够溯源至国家或国际标准。

可以由校准品的生产商提供相关的校准程序和溯源证明。
对于开放试剂的仪器设备,特别注意试剂说明书要求的操作条件与仪器性能是否相适应。

如果仪器性能与试剂盒说明书的要求有差异,可以征得试剂生产商协助和同意,对本实验室仪器的试验操作参数进行修正,以达到试剂盒要求的试验状态。

B.4.1.4质量控制应建立有效的质量控制程序。
选择质量、来源稳定,无基质效应的质控品作为室内质控物。
确认试验采用的标本不能等同于质控品使用。
应确保试验过程处于受控状态,否则必须重新试验。
B.4.1.5保持试验记录应记录和监控操作人员在试验过程中的健康安全,确保符合法律要求。
保留检测全过程的数据和结果,包括检测的速度和使用的适宜性等。
B.4.2正确度的估计正确度估计更常用的方法:方法比较试验:采用新的检测方法和参加过能力验证的检测方法或公认的参考方法,同时检测一批不同ALT浓度的标本。
通过结果的差异了解新系统引入后的偏倚是否在允许误差范围内。
通常将新系统方法称为比较方法(y),与之比较的系统方法称为参考方法(x),该试验也称为方法学比较试验。
能力验证活动:直接参加权威机构组织的能力验证活动,能力验证的成绩可以证明新的检测方法检测结果的准确性。
以下为方法比较试验的设计和数据分析过程。
B.4.2.1标本的选择B.4.2.1.1标本数量:试验标本数至少40份,更多的标本量可以使试验结果更加可靠。
每份标本应有足以完成双份测定的量。
如果不够,可以将分析物浓度接近的两份标本混合使用。

B.4.2.1.2标本分析物浓度范围:如可能,应选择有50%试验标本的分析物浓度不在参考范围内。
B.4.2.2试验程序时间至少5天。
采用两种方法,将标本按照序号递增和递减的顺序测定2次。
如第1次检测序号为
1、2、3、4、5、6、7、8、第2次为8、7、6、5、4、3、2、
1、当天的方法比较试验应在2小时内完成。

B.4.2.3数据分析B.4.2.3.1初步判断:剔除有明显人为误差的结果。
内部质控失控时,必须重新检测。
B.4.2.3.2离群点的剔除:设参考方法测定结果为x值,第一次测定值为x
1、第二次测定值为x2、比较方法测定结果为y值,第一次测定值为y
1、第二次测定值为y2、B.4.2.3.3方法内重复测定值离群点的去除计算△xi=∣xi1-xi2∣, △yi=∣yi1-yi2∣计算计算4以4计算计算更终以4B.4.2.3.4方法间配对结果离群点的去除计算Eij=∣yij-xij∣,i为标本序号1~40、j为重复结果序号1或2、计算以4B.4.2.3.5初步判断线性回归状况x-y散点图以参考方法所有结果为x值,比较方法所有结果为y值,绘制散点图。

以参考方法每个标本两次检测结果的均值为x值,比较方法每个标本两次检测结果的均值为y值,绘制散点图。
比较两图有无明显差异。
如无明显差异,说明方法比较试验的随机误差对比较结果影响不大。
x均值(x-y)均值差散点图以参考方法每个标本两次检测的均值为x值,两方法试验结果均值差(x-y)为y值,绘制散点图。
观察均值差随x值增大的变化。
如果点的分布表现出一定的趋势,预示着两方法之间系统误差的存在。
B.4.2.3.6标本分析物浓度分布检验试验点的离散度和对应分析物浓度分布的宽度都会影响r值的大小。
一般如果r≥0.975(r2≥0.95),x取值范围适宜,否则应扩大数据范围。
B.4.2.3.7线性回归计算每份标本用两个方法进行两次测定。
将参考方法的x1和比较方法的y1对应,参考方法的x2和比较方法的y2对应,组成成对数据。
采用所有成对数据进行直线回归。

得回归方程B.4.2.4可接受标准r≥0.975或r2≥0.95、医学决定水平处新方法引入的系统误差小于CLIA’88允许误差的1/2、B.4.3精密度的估计精密度估计更常用的方法是采用稳定的标本进行重复检测。
求得均值(x)、标准差(s)和变异系数(CV)。
精密度的好坏通常采用不精密度表示,不精密度通常以CV体现。
应在明确标本的来源、浓度、试验周期的前提下,确定检测方法的不精密度。

B.4.3.1标本的选择B.4.3.1.1标本分析物浓度范围:鉴于血站血液检测实验室检测对象为健康的献血人群,可采用中、低两个ALT浓度的标本进行精密度试验。
标本的基质应近似于人源标本。

B.4.3.1.2标本的保存:精密度试验需要在若干天内完成,对于冰冻保存的标本和冻干复溶标本,应严格控制操作手法均一、复溶时间、加液的准确性、混匀的力度等,力求试验标本的稳定、均一。
B.4.3.2试验程序B.4.3.2.1对每个水平的标本分别做批内和天间的重复测定。
精密度试验与常规标本检测同时进行,不可替代试验的质量控制过程。
B.4.3.2.2批内试验:将试验标本插入常规检测标本一同检测。

一批内连做20次。

对应质控结果为受控状态。

B.4.3.2.3批间试验:每天对试验标本做1次检测,连做20天。
每天对应质控结果为受控状态。
B.4.3.3数据分析B.4.3.3.1标准差计算批内和天间标准差均可采用以下公式计算B.4.3.3.2变异系数计算批内和天间变异系数均可采用以下公式计算B.4.3.4可接受标准参照Westgard和Ceroblewski等提出高效检验对精密度要求的观点,批内不精密度CV应小于CLIA允许误差的1/4、批间不精密度CV应小于CLIA允许误差的1/3、对于ALT试验,CLIA允许误差限值T±20%,因此ALT检测方法的批内不精密度CV应小于5%,批间不精密度CV应小于6.7%。
B.4.4检测可报告范围检测可报告范围确认试验通常采用配制包含不同分析物浓度的系列标本进行检测,将按稀释比例计算的预期值和实际测量值设置为两个变量进行线性回归。

回归直线应当为过原点,斜率为1的直线。
直线所达的限值即为结果的检测范围。
B.4.4.1标本的选择B.4.4.2试验程序检测系列血清,每份标本重复4次。
B.4.4.3数据分析B.4.4.3.1剔除异常点:剔除明显异常的检测结果,并补充数据。
B.4.4.3.2计算预期值:计算低值和高值标本的结果均值。
按照稀释关系,计算每个标本的分析物理论浓度,即为预期值。
B.4.4.3.3预期值-实测值的线性回归:每个标本有4个重复试验的实测值。
每个实测值与其预期值相对应,形成成对数据。
以x表示预期值,y表示实测值,描点绘图。
得到回归方程B.4.4.3.4初步判断:理想状态下B.4.4.3.5如果b不接近
1、B.4.4.3.6可以通过以下统计假设检验进行判断。
B.4.4.3.6.1截距a和0差异的t检验假设H0:a=0,H1: a≠0,计算计算计算B.4.4.3.6.2斜率b和1差异的t检验假设H0:b=1,H1: b≠1,计算计算计算B.4.5正常值参考范围确认采用新方法对20份健康献血者血液标本进行检测。
更多允许1个结果不在试剂盒提供的参考范围内。
B.5ABO血型和RhD抗原检测方法的确认以下内容适用于献血者血型血清学方法确认。
B.5.1确认的一般要求B.5.1.1试验操作的培训开始确认新的检测方法之前,操作人员应当有充分的时间熟悉新系统,确定关键的操作步骤。
生产商应提供试剂或仪器的操作说明,试验原理,规格,试验步骤,局限性,质量控制和健康安全信息。
生产商应对操作者进行培训,确保操作人员正确操作。
B.5.1.2试剂的准备应选择国家批准使用的血型试剂,严格遵从生产商的说明书进行操作。

对于正在进行确认的试剂,所有组份应来源于同一批试剂,不能由其他试剂所替代(即使另一种试剂为同一厂家生产)或实验室自己配制。
实验室对试剂自行修改,如稀释试剂,应取得生产商的认可,因为任何修改可以导致对试剂的质量保证失效,并产生相关责任。
B.5.1.3仪器的准备应选择国家批准使用的检测仪器。
试验开始前,按照要求对仪器进行维护校准。
对于开放试剂的仪器设备,特别注意试剂说明书要求的操作条件与仪器性能是否相适应。
如果仪器性能与试剂盒说明书的要求有差异,可以征得试剂生产商协助和同意,对本实验室仪器的试验操作参数进行修正,以达到试剂盒要求的试验状态。

B.5.1.4质量控制应建立有效的质量控制程序。
确保常规平行试验中已知抗原和已知抗体的质控物反应正确,否则必须重新试验。
B.5.1.5保持试验记录应记录和监控操作人员在试验过程中的健康安全,确保符合法律要求。
保留检测全过程的数据和结果,包括检测的速度和使用的适宜性等。
B.5.2平行确认试验所有实验室应采用平行试验的方式,用常规标本,将新方法与现用方法进行比较,确认新方法的常规使用状态,时间更短1周,操作程序和结果应文件化。

应定期进行关键标本(弱抗原或弱抗体标本)重复试验,确认方法的稳定性和耐用性。
B.6确认记录B.6.1试验过程记录应包括:B.6.1.1检测标本类型及各类型数量,B.6.1.2检测日期,B.6.1.3操作试验者的级别和能力,B.6.1.4使用试剂的详细资料,包括:批号、效期等,B.6.1.5采用修正条件的详细资料,如温度、孵育时间,离心力、加速减速率、离心时间,B.6.1.6设备详细资料,B.6.1.7判读方法的详细资料,包括适当的cutoff值。

B.6.2试验结果记录应包括:B.6.2.1所有结果并绘制表格,包括阳性反应和阴性控制结果,B.6.2.2差异结果、数量和类型,以表格形式体现。
B.6.3确认结论记录应包括:B.6.3.1用户界面友好性,B.6.3.2操作人员需要的水平,培训要求,B.6.3.3新产品/系统的实用性、耐用性,自动化效能,B.6.3.4不同情况下使用的适宜性(批量标本处理或单一紧急标本处理),B.6.3.5新产品/系统的贮存期,包括贮存末期的性能,B.6.3.6方便的仪器维护,B.6.3.7健康安全方面,包括数据采集和处理安全性,B.6.3.8任何过程中暴露的系统弱点和对系统改进的建议,并通知生产商,如果生产商对此实施了改进方案,重新试验的结果应在报告中体现。
附录C血液检测试剂(血清学检测/核酸检测试剂)进货验收与放行记录表1订购试剂品名 规格 生产方销售方 销售员姓名及身份证号码试剂产销证照是否齐全有效?
采购合同是否有效?

订购数量 订购价格 订购者 订购日期2验货与隔离验货结论 仓管员 验货日期2.1外观检查(箱体完整无损,运输冷链符合要求,试剂包装盒完整无损,无液体泄漏)2.2到货数量 销售凭证内容(购货单位、试剂、供货商等名称,规格、批号、数量、价格)2.3批号 出厂质量检验报告 SFDA批签发文件2.4隔离存放(将试剂存放于℃隔离冰箱)3抽样与收样(任意抽样1件)抽样者 日期 收样者 日期4测试测试结论 测试者 日期4.1试剂说明书版本检查4.2试剂盒组成、组分性状与说明书一致,无泄漏,足量,标识正确4.3采用测试样本,按照试剂说明书进行检测4.3.1试剂盒阴性、阳性对照品检测结果符合试剂说明书要求4.3.2以现用室内质控品检测,结果符合室内质控程序的要求4.3.3其它检测要求:5审批(1)准予放行使用。
实验室主管: 日期: 质量部门主管: 日期:(2)退货。
实验室主管: 日期: 质量部门主管: 日期:6放行①“可用”标识,② 账物入合格品库,③ 向BMIS录入试剂信息仓管员 日期:7附件:① 销售员身份证复印件,② 出厂质量检验报告,③ SFDA批签发文件,④ 试剂说明书,⑤ 测试记录8 附注:国家食品药品监督管理局简称SFDA附录D血液检测室内质控方法D.1总则血站血液检测主要包括用于血清学抗体或抗原检测的ELISA或CLIA试验,用于HBV/HCV/HIV DNA或RNA检测的NAT试验,以及ALT酶学试验。

ELISA或CLIA试验的室内质控通常采用试剂盒阴阳性对照、弱阳性质控品实时监控试验的有效性,同时采用弱阳性质控品和Levey-Jennings质控图监控试验的稳定性。
ALT作为定量试验通常采用Levey-Jennings质控图监控ALT试验的精密性和有效性。
NAT试验以及其它定性试验可选择适当浓度的质控物,采用定性检测结果合格即判为在控的方法。
D.2血清学试验过程稳定性控制推荐采用Levey-Jennings质控图监控ELISA或CLIA试验过程的稳定性,发现随机误差和系统误差。

实验室如需采用更多种类的控制图进行质控,可查阅相关文献。

D.2.1质控规则D.2.1.1质控规则的表示方法用D.2.1.2质控规则的选用实验室可选择Levey-Jennings质控图常规使用的13s规则作为在控与失控的判断规则,如发现违背13s规则的情况,说明试验过程没有处于受控状态,应查找原因予以解决。

实验室应根据实际情况,同时选择一个监控试验系统误差的规则,如7x规则,以发现由于仪器、试剂、环境条件等因素引起的系统误差。

上述常用质控规则的释义如下:13s:一个质控值超过7x:7个连续的质控值落在均值一侧,用于提示可能存在系统误差。
D.2.2质控图的建立D.2.2.1设定质控图均值和标准差在实验室常规检测条件下,连续测定同一批号的弱阳性质控品10~20天,收集至少20个质控数据,对数据进行离群值检验,剔除超过±3s以外的数据,计算均值及标准差,以此控制后续试验过程,直至试剂或质控品批号更换。
实验室如采用积累质控数据计算均值和标准差,具体方法可参见本章节ALT质控均值的计算。
但需注意,由于核酸和血清学试剂可能存在较大的批间差异,积累质控数据计算的方式可能增大室内质控的标准差和变异度,因此如两批试剂的质控均值和标准差有显著差异,建议针对新批号试剂重新计算质控均值和标准差。
实验室构建质控图的过程中,如果发现试验变异度过大,应采取措施,稳定各个环节试验条件,将变异度控制在可接受范围内。
通常情况下,ELISA试验的变异系数宜控制在20%以内。
D.2.2.2设定质控图控制限控制限通常是以标准差的倍数来表示。
Levey-Jennings质控图将D.2.2.3绘制质控图以Y轴为质控品的测定值(S/CO值),X轴为质控个数或单位时间。
Y轴刻度上各水平线分别为均值、当采用13s规则可采用单点质控图,将质控数据逐一点于质控图上进行观察,以发现试验随机误差。
当采用7x规则,可根据实验室情况,采用单点质控图或将一个单位时间内(通常为一天)所有质控数据的均值点于质控图上进行观察,以发现检测系统的变化和趋势。

D.2.2.4质控图框架的重建如果更换新批号试剂,鉴于ELISA 或CLIA试验的特性和试剂批间的不稳定性,可能两批试剂质控均值和标准差存在显著差异,如需要应重新建立质控图框架。
如果更换新批号质控品,在试剂批号不变的情况下,可采用将新批号质控品和旧批号质控品同时检测的方式,以确保在旧批号质控品使用结束前,获得计算新批号质控品均值和标准差的数据,建立质控图框架。
如果质控图使用过程中,出现均值的偏移和标准差变化,需分析并消除产生偏差的原因,必要时应重新调整质控图框架。
D.2.3失控情况的分析处理如出现违背试验有效性判定规则,应视为试验无效。
查找原因,采取纠正措施后重新试验。
如违背实验室选择的质控规则,出现随机误差或系统误差,实验室应分析产生误差原因。
引起误差的因素通常包括操作上的失误,试剂、校准物、质控品的失效,试剂、质控品更换批号或保存末期发生变化,仪器使用维护不当,质控图建立过程中采用的数据不足造成均值和标准差不适宜等。
应采取纠正措施,消除产生误差的因素。
如果所选择弱阳性质控品超过规定的S/CO值上限,应关注违背-3s规则时的试验状况,必要时对阴性结果重新检测。
应保存失控情况分析处理记录。
D.3ALT实验室内质控D.3.1质控规则的选用D.3.2质控图的建立D.3.2.1设定质控图均值:在实验室常规检测条件下,测定同一批号的质控品10~20天,收集至少20个质控数据,对数据进行离群值检验,剔除超过±3s以外的数据,计算临时均值及标准差,以此控制此后一个月的室内质控情况。
一个月结束后,汇集当月所有质控数据,计算所有在控数据积累的质控均值和标准差,以此控制下一个月的室内质控情况。
重复以上操作三到五个月,更终汇集前20个数据和三到五个月的质控数据,计算积累的质控均值和标准差,以此作为常规均值和标准差,控制以后的试验过程,直至质控品批号更换。
D.3.2.2设定质控图控制限:控制限通常以标准差的倍数表示。
Levey-Jennings质控图将D.3.2.3绘制质控图D.3.2.4质控图的重建:鉴于ALT试验的特性,质控图可包含多个试剂批号的变化。
如果更换新批号质控品,可采用将新批号质控品和旧批号质控品同时检测的方式,以确保在旧批号质控品使用结束前,获得计算新批号质控品均值和标准差的数据,建立质控图。
D.3.2.5如果质控图使用过程中,出现均值的偏移和标准差变化,需分析并消除产生偏差的原因,必要时应重新构建质控图。
D.3.3失控情况的分析处理:如出现违背质控规则的情况,需分析产生误差的类型及原因,并视为试验失控和无效。

应查找原因,采取纠正措施后重新试验。
引起误差的因素通常包括操作上的失误、试剂、校准物、质控品的失效,试剂、质控品更换批号或保存末期发生变化,仪器使用维护不当,由于质控图建立过程中采用的数据不足造成均值和标准差不适宜等。
应保存失控情况分析处理记录。
D.4特殊情况下的室内质控对于不能每天进行血液检测、质控数据量少的实验室,必须保证每次试验满足试剂盒质控要求,弱阳性质控品S/CO≥
1、在次基础上,可适时采用Grubbs氏法进行室内质控。
该方法只需连续测定3次,即可对第3次检验结果进行检验和控制。
具体计算方法如下。
1)计算出测定结果(至少3次)的平均值(2)计算SI上限值和SI下限值:SI上限 = (X更大值-SI下限 = (3)查表
1、将SI上限和SI下限与SI值表中的数值进行比较。
表1SI值表nn3sn2snn3sn2s31.151.15122.552.2941.491.46132.612.3351.751.67142.662.3761.941.82152.702.4172.101.94162.752.4482.222.03172.792.4792.322.11182.822.50102.412.18192.852.53112.482.23202.882.56当SI上限和SI下限值<n2s时,表示处于控制范围之内,可以继续进行测定,并重复以上计算,当SI上限和SI限有一值处于n2s和n3s值之间时,说明该值在2s–3s范围,处于“警告”状态,当SI上限 和 SI下限有一值>n3s时,说明该值已在3s范围之外,属“失控”。

数字处于“失控”状态应舍去,重新测定质控品和标本。

舍去的只是失控的这次数值,其它次测定值仍可继续使用。
当检测的数字超过20次以后,可转入使用常规的质控方法进行质控。

D.5室内质控数据的管理D.5.1实验室应定期对所有检测项目的室内质控数据进行统计分析,对质控图进行评价和维护,以确保室内质控的有效运行。
D.5.2实验室应定期对所有检测项目的室内质控数据、质控图以及失控报告单整理后进行存档。

D.5.3实验室负责人(或由负责人指定的授权人)应定期对室内质量控制的记录进行审核并签字。

附录E微板法ABO血型定型试验E.1本附录描述了基于手工操作或半自动操作的U型微板技术的基本步骤。
E.2正定型(细胞定型)E.2.1在微板的3个干净孔内分别加入1滴抗-A、抗-B,(如需要,可在第三孔内加1滴抗-AB进行平行试验)。

E.2.2在含有血型定型试剂的各孔内加入1滴1.6%~1.8%红细胞悬液,轻叩板边,混匀孔内物质。
可以采用自动化的样本处理系统完成抗血清和受检红细胞悬液的配制和加样。
E.2.3离心和重悬。
离心结束后用手轻叩微板或借助微板振荡器重悬细胞扣。

E.2.4肉眼观察红细胞是否凝集,判读结果并记录,并与反定型结果比较。
也可以采用具有血型判读功能的酶标仪进行结果的自动判读。
E.3反定型(血清定型)E.3.1在微板的两个干净孔内,每孔内加1滴受检者血清或血浆,E.3.2在含有血清或血浆的各孔内分别加1滴1.6%~1.8%A
1、B细胞(如需要,可添加A2或O细胞进行附加试验),轻叩板边,混匀孔内物质。
可以采用自动化的样本处理系统完成受检血清/血浆和试剂红细胞悬液的配制和加样。
E.3.3离心和悬浮。

采用既定的离心条件对微板进行离心。
结束后用手轻叩微板或借助微板振荡器重悬细胞扣E.3.4肉眼观察红细胞是否凝集,判读结果并记录,并与正定型结果比较。
也可以采用具有血型判读功能的酶标仪进行结果的自动判读。
E.4结果判读与解释E.4.1红细胞溶血或在微板底部形成凝集细胞扣都表示阳性结果,E.4.2重悬细胞扣后,无红细胞凝集或溶血表示阴性结果,E.4.3若正反定型结果不符,应分析不一致的原因,并进一步试验以确定血型。
E.5注意事项E.5.1如果使用稀释的抗血清工作液,应关注抗血清试剂的强度和粘度,蛋白浓度过高或过低都会影响检测结果。
稀释后工作液的保存不应超过1周。
E.5.2抗血清工作液的配制和红细胞悬液的配制应标准化。
E.5.3微板使用前可以用0.1%的牛白蛋白或人血清进行预处理以减少塑料的非特异性吸附。
加热洗涤或用湿巾擦拭U型孔底可减少静电作用。

使用后的微板必须彻底清洗方可重复使用。
E.5.4离心条件和离心后对微板的悬浮条件应标准化。
通常软质U型板离心条件700g×5秒(g为重力加速度),硬质U型板离心条件400g×30秒,硬质V型板离心条件700g×10秒。
悬浮条件应关注悬浮的频率、幅度和时间。
E.5.5如果血型试剂未注明可用于微板试验,或检测设备为非系统型,实验室应对微板法血型定型的各个试验条件进行优化和验证。
以确保血型检测的准确性。

附录F血液质量控制检查方法F.1外观F.1.1检查方法:于光线明亮处目视检查F.2标签F.2.1检查方法:于光线明亮处目视检查F.3容量F.3.1检查方法F.3.1.1称量血袋重量F.3.1.2计算公式注:如果适用,还应减去抗凝剂容量。
F.4无菌试验F.4.1检测方法无菌试验方法遵从中华人民共和国药典(2015年版)三部“无菌检查法”要求。
使用细菌培养仪进行无菌试验应参照厂家使用说明书。
F.4.2注意事项留取血液样本前,应当将血袋中的血液充分混匀,混匀时动作应轻柔,不能产生泡沫,也不能使其溶血。
F.5Hb测定检测方法见《全国临床检验操作规程》(第4版)“血红蛋白测定”。
使用血细胞计数仪测定的应参照厂家使用说明。
F.6游离Hb测定检测方法参照《全国临床检验操作规程》(第4版)“血浆游离红蛋白测定”。
F.7血细胞比容检测方法见《全国临床检验操作规程》(第4版)“红细胞比容”。
使用血细胞计数仪测定的应参照厂家使用说明。
F.8储存期末溶血率F.8.1检测方法在血液储存期的更后一周内取样,按 F.5、F.6和F.7测定总血红蛋白、上清游离血红蛋白、血细胞比容。
F.8.2计算公式F.9白细胞残留量F.9.1检测方法用留取的去白细胞血液标本进行残余白细胞检测。
材料:大容量 Nageotte血细胞计数盘、显微镜、结晶紫染色液。

结晶紫染色液配制储存液配制:250mg结晶紫溶于250ml的50%醋酸溶液中。
室温放置可保存6个月。
使用液配制:1份储存液加9份3%的醋酸溶液,更终浓度为:结晶紫0.01mg%(W/V),醋酸7.7%(V/V)。
然后使用0.22μ过滤器过滤。
计数方法:50μl血液标本加入450μl使用液中,充分混匀。
在Nageotte计数池中加入上述混合液,将计数池置于带盖潮湿容器中,于室温放置10~15分钟。
在200倍显微镜下对计数池中两个计数区(每区有20个长方形格)的白细胞计数,40行相当于50μl。

计算:Nageotte计数盘公式中:10为稀释倍数,50μl为计数池2个区的容积每袋中残余白细胞数按下列公式计算:残余白细胞数/袋=白细胞数/ml×去白细胞血液容量(ml)/袋或使用其它经验证可使用的方法。

F.10红细胞计数检测方法见《全国临床检验操作规程》(第4版)“红细胞计数”。
使用血细胞计数仪测定的应参照厂家使用说明。
F.11血小板计数检测方法见《全国临床检验操作规程》(第4版)“血小板计数”。
使用血细胞计数仪测定的应参照厂家使用说明。
F.12血浆蛋白测定检测方法见《全国临床检验操作规程》(第4版)“血清总蛋白的测定”。
F.13上清液蛋白含量检测方法参照《全国临床检验操作规程》(第4版)“脑脊液总蛋白测定”。
F.14pH测定F.14.1测定方法测定方法见《中华人民共和国药典》(2015年版)三部附录“pH值测定法”。
F.14.2注意事项使用国家计量部门检定合格的pH 仪。
样品从血袋中移出后应立即进行检测,以防标本在空气中暴露时间过长而CO2逸出,导致pH测定值比实际值偏高。
F.15凝血因子Ⅷ活性测定测定方法见现行有效的《全国临床检验操作规程》“凝血因子Ⅷ的活性测定(一期法)”。
使用血凝仪测定时参照厂家使用说明书。
F.16纤维蛋白原测定测定方法见《全国临床检验操作规程》(第4版)“血浆纤维蛋白原含量测定”。
使用血凝仪测定应参照厂家使用说明书。

根据冷沉淀的容量计算出每袋纤维蛋白原含量。
F.17甘油残留量F.17.1过碘酸钠法原理:根据过碘酸钠能氧化有机化合物中的羟基、胺基,使甘油氧化成酸和醛,以溴甲酚紫作指示剂,并用氢氧化钠进行滴定。
从消耗氢氧化钠的毫升数,即可算出样品中所含甘油的量。
试剂:16.5%钨酸钠溶液:称取16.5克钨酸钠,用蒸馏水溶解,再加蒸馏水稀释至100ml。
0.5mol/L H2SO4:吸30ml浓硫酸缓缓注入水中,冷却至室温,加水稀释至1000ml。
0.1mol/L NaOH:配制方法见《中华人民共和国药典》(2015年版)二部附录“滴定液”0.1%溴甲酚紫溶液:0.1g溴甲酚紫溶入20ml0.02mol/L NaOH溶液中,再加入蒸馏水稀释至100mL。

14%过碘酸钠:14g过碘酸钠先加入少量蒸馏水中溶解,加入2mL浓硫酸使其完全溶解,用蒸馏水稀释至100mL。
操作方法:按下表操作步骤制备血滤液血滤液制备试剂mL备注测定样品15.0蒸馏水75.016.5% Na2WO46.00.5mol/LH2SO47.5用力振摇,进行过滤注:试验操作时应在三角烧瓶中进行分析测定的步骤如下表:试剂空白(mL)样品(mL)备注过滤后的上清液蒸馏水0.1%溴甲酚紫溶液0.1mol/L NaOH溶液14%过碘酸钠38℃恒温0.1%溴甲酚紫溶液0.1mol/L NaOH溶液100.010.015100.010.02滴滴定至蓝色15分钟2滴滴定至蓝色计算:0.1mol/L NaOH溶液相当于0.00921g甘油F.17.2渗透压测定法正常血清的渗克分子浓度为289mmol(289mOsm),甘油含量为1%(10g/L)时,其渗克分子浓度为420mmol(420mOsm),因此渗透压测定法可作为一种检测去甘油红细胞甘油残存量的参考方法,操作方法应参照渗透压仪器生产厂家使用说明书。
F.17.3折射仪测定法F.17.4由于不同方法的准确性和精密度存在差异,可根据要求选择以上相应方法或其它方法(如:GPO-PAP二步法)。
若采用商品化试剂盒,操作应按试剂盒说明书进行。
F.18中性粒细胞计数检测方法见《全国临床检验操作规程》(第4版)“白细胞计数”。
使用血细胞计数仪测定的应参照厂家使用说明。

F.19亚甲蓝残留量F.19.1测试样品准备取3 mL Waters Oasis小柱,置于真空萃取装置上,用6mL甲醇活化,加入6mL供试血浆,萃取亚甲蓝,用30%甲醇6mL清洗,随后用含1%乙酸的甲醇溶液2mL洗脱,洗脱液离心(3500rpm/10分钟),取上清液作为样品溶液。
F.19.2标准品的制备取亚甲蓝粉末约38mg,精密称定,置100mL量瓶中,用水溶解并稀释至刻度。
精密量取50μl置50mL容量瓶中,用血浆稀释至刻度,配成更终浓度为约1.0μmol/L的亚甲蓝对照血浆。

检测过滤前后样品溶液时,必须用同样的方法萃取检测标准品。
F.19.3测定用含1%乙酸的甲醇溶液作试剂空白,在654nm±2nm波长处测定吸光度。
按以下公式计算亚甲蓝在血浆中的残留量:血浆中亚甲蓝浓度(μmol/L)F.19.4注意事项病毒灭活冰冻血浆在留取标本前应置30~37℃融化,融化时间应小于6分钟。
为使其尽快融化,应不断轻柔摇动血浆袋。
不得急剧摇动血浆袋,以防止血浆中出现大量泡沫。
附录G血袋标签确认方法G.1范围本法适用于对拟采用的新的供应方所生产的标签的确认活动。

G.2标签纸质和粘贴牢固度G.2.1质量标准1)标签的底色应为白色,上面的字体建议采用实体黑色字体。
2)全血标签经离心后,血浆标签经离心、冷冻、水浴后,标签不能分离。
3)标签外观没有破损,相对平整。

如出现皱褶,不能影响条码的扫描和读码。
4)粘贴在导管上的条码,经离心、冷冻后在常温条件下自然融化2小时,条码与导管之间不能出现分离。
5)对直接粘贴在冰冻血浆(制品表面不平整)袋上的标签,粘贴时制品不需擦拭,可直接粘贴,不能出现标签打滑的现象。
对冷藏后血液制品上的标签,应进行血袋与血袋之间、手指与标签之间进行摩擦,摩擦后标签上的油墨不得脱落。
G.2.2测试方法-离心试验方法按采供血过程血袋标签粘贴的操作程序,将抽检标签粘贴于规定的部位(血袋上、标签上或留样皮管)上,在分离红细胞和血浆的离心条件下离心30分钟。

离心时将粘贴有标签的血袋按离心杯的容量整齐地摆放于离心杯中。
G.2.3测试方法(冷冻试验方法)将血液和制品需冷冻的抽检标签粘贴于规定的部位(血袋上、标签上或留样导管)上,放置-18℃低温冰箱冷冻24小时。
G.2.4测试方法-水浴试验方法对需经水浴的血液制品标签应进行水浴试验。
取出粘贴有标签的冷冻血袋,放入于37℃温水池中水浴60分钟(低温沉淀物制品在2~6℃水浴4小时,再放入37℃温水池中水浴60分钟)后取出。
G.2.5测试方法-粘贴牢固度试验方法对直接粘贴在冰冻血浆袋上的标签,应将标签直接粘贴在冰冻好的血袋上。
G.2.6测试方法-冷藏的试验方法对需冷藏的血液制品标签放入2-6℃的冷藏冰箱,24小时后取出。
G.2.7注意事项标签粘贴牢固度试验在操作时应将标签平整地粘贴在血袋上。
采供血过程中未规定的标签粘贴过程不应作为标签粘贴牢固度试验的过程。
G.3条码扫描和读码G.3.1质量标准各类条码在常温、冷藏、冷冻、水浴后均能为条形码识读器所读码。
G.3.2测定方法各类条码在常温、冷藏、冷冻、水浴后用条形码识读器读取。
G.4印章和书写字迹清晰度G.4.1质量标准标签在加盖印章和油性笔书写后,印章油印及书写字迹待干后不发生严重模糊,或部分发生模糊但仍能够清楚地辩读。

G.4.2测定方法将标签加盖印章和使用指定的油性笔书写,观察其清晰程度。

G.5标签安全性能检测报告:标签厂家应提供标签材质安全性能检测报告,以证明其不影响血液质量。
附录H(资料性附录)血站使用的强制检定工作计量器目录H.1本目录内项目,凡用于贸易结算、安全防护、医疗卫生、环境监测的,均实行强制检定。

H.2本目录所列的计量器具是根据血站实际工作情况,从《中华人民共和国强制检定的工作计量器具目录》节录而成,并对序号进行了重新编排。

包括:1)玻璃液体温度计:玻璃液体温度计,2)体温计:体温计,3)砖码:砝码,4)天平:天平,5)秤:电子秤,6)酒精计:酒精计,7)密度计:密度计,8)血压计:血压计、血压表,9)照射量计(含医用辐射源):照射量计、医用辐射源,10)电离辐射防护仪:射线监测仪、照射量率仪、放射性表面污染仪、个人剂量计,11)声级计:声级计,12)酸度计:酸度计、血气酸碱平衡分析仪,13)火焰光度计:火焰光度计,14)分光光度计:可见光分光光度计、紫外分光光度计、红外分光光度计、荧光分光光度计、原子吸收分光光度计,15)比色计:滤光光电比色计、荧光光电比色计,16)血球计数器:电子血球计数器。
附录I献血者健康检查要求1 总则1.1采集血液前应征得献血者的知情同意,并对其进行必要的健康征询、一般检查和血液检测。

1.2献血者献血前的一般检查和血液检测应以血站结果为准,有效期为14天。
1.3献血前健康检查结果只用于判断献血者是否适宜献血,不适用于献血者健康状态或疾病的诊断。

1.4对经健康检查不适宜献血的献血者,应给予适当解释,并注意保护其个人信息。
2 献血者知情同意2.1 告知义务血站工作人员应在献血前对献血者履行书面告知义务,并取得献血者签字的知情同意书。

2.2 告知内容2.2.1献血动机无偿献血是出于利他主义的动机,目的是帮助需要输血的患者。

国家提供艾滋病免费咨询和艾滋病病毒抗体检测服务,如有需要,请与当地疾病预防控制中心联系。
2.2.2安全献血者的重要性不安全的血液会危害患者的生命与健康。
具有高危行为的献血者不应献血,如静脉药瘾史、男男性行为或具有经血传播疾病(艾滋病、丙型肝炎、乙型肝炎、梅毒等)风险的。
2.2.3具有高危行为者故意献血的责任献血者捐献具有传染性的血液会给受血者带来危险,应承担对受血者的道德责任。
根据《中华人民共和国传染病防治法》第77条、《艾滋病防治条例》第38条和第62条规定,高危献血者故意献血,造成传染病传播、流行的,依法承担民事责任,构成犯罪的,依法追究刑事责任。
2.2.4实名制献血根据《血站管理办法》规定,献血者在献血前应出示真实有效的身份证件,血站应进行核对并登记。
冒用他人身份献血的,应按照相关法律规定承担责任。
2.2.5献血者献血后回告献血者如果认为已捐献的血液可能存在安全隐患,应当尽快告知血站。
血站应当提供联系电话。
2.2.6献血反应绝大多数情况下,献血是安全的,但个别人偶尔可能出现如头晕、出冷汗、穿刺部位青紫、血肿、疼痛,或头晕、出冷汗等不适,极个别可能出现较为严重的献血反应,如晕厥。
医务人员应当对献血反应及时进行处置,献血者应遵照献血前和献血后注意事项,以减低献血反应的发生概率。
2.2.7健康征询与检查根据《中华人民共和国献血法》的规定,须对献血者进行健康征询与一般检查,献血者应该如实填写健康状况征询表。
不真实填写者,因所献血液引发受血者发生不良后果,应按照相关法律规定承担责任。
2.2.8血液检测血站将遵照国家规定对献血者血液进行经血传播疾病的检测,检测合格的血液将用于临床,不合格血液将按照国家规定处置。
血液检测结果不合格仅表明捐献的血液不符合国家血液标准的要求,不作为感染或疾病的诊断依据。
2.2.9疫情报告根据《中华人民共和国传染病防治法》等相关规定,血站将向当地疾病预防控制中心报告艾滋病病毒感染等检测阳性的结果及其个人资料。
2.3献血者知情同意献血者应认真阅读有关知情同意的资料,并签字表示知情同意。

3 献血者健康征询3.1 献血者有下列情况之一者不能献血3.1.1 呼吸系统疾病患者,如包括慢性支气管炎、支气管扩张、支气管哮喘、肺气肿、以及肺功能不全等。
3.1.2 循环系统疾病患者,如各种心脏病、高血压病、低血压、四肢动脉粥样硬化、血栓性静脉炎等。
3.1.3 消化系统疾病患者,如慢性胃肠炎、活动期的或经治疗反复发作的胃及十二指肠溃疡、慢性胰腺炎、非特异性溃疡性结肠炎等。
3.1.4 泌尿系统疾病患者,如急慢性肾小球肾炎、慢性肾盂肾炎、肾病综合征、慢性泌尿道感染以及急慢性肾功能不全等。
3.1.5 血液系统疾病患者,如贫血(缺铁性贫血、巨幼红细胞贫血治愈者除外)、真性红细胞增多症、粒细胞缺乏症、白血病、淋巴瘤及各种出、凝血性疾病。
3.1.6 内分泌系统疾病及代谢障碍疾病患者,如脑垂体及肾上腺疾病、甲状腺功能性疾病、糖尿病、肢端肥大症、尿崩症等。
3.1.7 免疫系统疾病患者,如系统性红斑狼疮、皮肌炎、硬皮病、类风湿性关节炎、大动脉炎等。
3.1.8 慢性皮肤病患者,特别是传染性、过敏性及炎症性全身皮肤病,如黄癣、广泛性湿疹及全身性牛皮癣等。
3.1.9 过敏性疾病及反复发作过敏患者,如经常性荨麻疹等、支气管哮喘、药物过敏等。
单纯性荨麻疹不在急性发作期间可献血。
3.1.10 神经系统疾病患者,如脑血管病、脑炎、脑外伤后遗症、癫痫等,以及有惊厥病史或反复晕厥发作者。
3.1.11 精神疾病患者,如抑郁症、躁狂症、精神分裂症、癔病等。

3.1.12 克-雅(Creutzfeldt-Jakob)病患者及有家族病史者,或接受可能是来源于克-雅病原体感染的组织或组织衍生物(如硬脑膜、角膜、人垂体生长激素等)治疗者。
3.1.13 各种恶性肿瘤及影响健康的良性肿瘤患者。
3.1.15 各种结核病患者,如肺结核、肾结核、淋巴结核及骨结核等。
3.1.16 寄生虫及地方病患者,如血吸虫病、丝虫病、钩虫病、肺吸虫病、囊虫病、肝吸虫病、黑热病及克山病和大骨节病等。
3.1.17 某些职业病患者,如放射性疾病、尘肺、矽肺及有害气体、有毒物质所致的急、慢性中毒等。
3.1.18 某些药物使用者,如长期使用肾上腺皮质激素、免疫抑制剂、镇静催眠、精神类药物治疗的患者,既往或现有药物依赖、酒精依赖或药物滥用者,包括吸食、服食或经静脉、肌肉、皮下注射等途径使用类固醇、激素、镇静催眠或麻醉类药物者等。
3.1.19易感染经血传播疾病的高危人群,如有吸毒史、男男性行为和多个性伴侣者等。
3.1.20 异体组织器官移植物受者:曾接受过异体移植物移植的患者,包括接受组织、器官移植,如脏器、皮肤、角膜、骨髓、骨骼、硬脑膜移植等。
3.1.21 接受过胃、肾、脾、肺等重要内脏器官切除者。
3.1.22 曾使受血者发生过与输血相关的传染病的献血者。
3.1.23 医护人员认为不适宜献血的其它疾病患者。

3.2 献血者有下列情况之一者暂不能献血3.2.1 口腔护理(包括洗牙等)后未满三天,拔牙或其他小手术后未满半个月,阑尾切除术、疝修补术及扁桃体手术痊愈后未满三个月,较大手术痊愈后未满半年者。
3.2.2 良性肿瘤:妇科良性肿瘤、体表良性肿瘤手术治疗后未满一年者。
3.2.3 妇女月经期及前后三天,妊娠期及流产后未满六个月,分娩及哺乳期未满一年者。
3.2.4 活动性或进展性眼科疾病病愈未满一周者,眼科手术愈后未满三个月者。
3.2.5 上呼吸道感染病愈未满一周者,肺炎病愈未满三个月者。
3.2.6 急性胃肠炎病愈未满一周者。

3.2.7 急性泌尿道感染病愈未满一个月者,急性肾盂肾炎病愈未满三个月者,泌尿系统结石发作期。
3.2.8伤口愈合或感染痊愈未满一周者,皮肤局限性炎症愈合后未满一周者,皮肤广泛性炎症愈合后未满二周者。
3.2.9 被血液或组织液污染的器材致伤或污染伤口以及施行纹身术后未满一年者。
3.2.10 与传染病患者有密切接触史者,自接触之日起至该病更长潜伏期。
甲型肝炎病愈后未满一年者,痢疾病愈未满半年者,伤寒病愈未满一年者,布氏杆菌病病愈未满二年者。
一年内前往疟疾流行病区者或疟疾病愈未满三年者,弓形体病临床恢复后未满六个月,Q 热完全治愈未满二年。

3.2.11 口服抑制或损害血小板功能的药物(如含阿司匹林或阿司匹林类药物)停药后不满五天者,不能献单采血小板及制备血小板的成分用全血。

3.2.12 一年内输注全血及血液成分者。
3.2.13 寄生虫病:蛔虫病、蛲虫病感染未完全康复者。

3.2.14 急性风湿热:病愈后未满二年或有后遗症者。
3.2.15 性行为:曾与易感经血传播疾病高危风险者发生性行为未满一年者。
3.2.16 旅行史:曾有国务院卫生行政部门确定的检疫传染病疫区或监测传染病疫区旅行史,入境时间未满疾病更长潜伏期者。

3.3 免疫接种或者接受生物制品治疗后献血的规定3.3.1无暴露史的预防接种3.3.1.1 接受灭活疫苗、重组DNA疫苗、类毒素注射者无病症或不良反应出现者,暂缓至接受疫苗24小时后献血,包括:伤寒疫苗、冻干乙型脑炎灭活疫苗、吸附百白破联合疫苗、甲型肝炎灭活疫苗、重组乙型肝炎疫苗、流感全病毒灭活疫苗等。
3.3.1.2 接受减毒活疫苗接种者接受麻疹、腮腺炎、脊髓灰质炎等活疫苗更后一次免疫接种二周后,或风疹活疫苗、人用狂犬病疫苗、乙型脑炎减毒活疫苗等更后一次免疫接种四周后方可献血。
3.3.2 有暴露史的预防接种被动物咬伤后接受狂犬病疫苗注射者,更后一次免疫接种一年后方可献血。
3.3.3 接受生物制品治疗者接受抗毒素及免疫血清注射者:于更后一次注射四周后方可献血,包括破伤风抗毒素、抗狂犬病血清等。
接受乙型肝炎人免疫球蛋白注射者一年后方可献血。

4 献血者一般检查4.1 年龄:国家提倡献血年龄为18周岁~55周岁,既往无献血反应、符合健康检查要求的多次献血者主动要求再次献血的,年龄可延长至60周岁。
4.2 体重:男≥50㎏,女≥45㎏。
4.3 血压:12.0 Kpa(90 mmHg)≤收缩压<18.7 Kpa (140 mmHg)8.0 Kpa(60 mmHg)≤舒张压<12.0 Kpa (90 mmHg)脉压差:≥30 mmHg/4.0 Kpa。
4.4 脉搏:60次~100次/分钟,高度耐力的运动员≥50次/分钟,节律整齐。
4.5 体温:正常。
4.6 一般健康状况:a)皮肤、巩膜无黄染。
皮肤无创面感染,无大面积皮肤病。

b)四肢无重度及以上残疾,无严重功能障碍及关节无红肿。
c)双臂静脉穿刺部位无皮肤损伤。

无静脉注射药物痕迹。
5 献血前血液检测5.1血型检测:ABO血型(正定型)。
5.2血红蛋白(Hb)测定:男≥120g/L,女≥115g/L。
如采用硫酸铜法:男≥1.0520、女≥1.0510、5.3单采血小板献血者:除满足8.2外,还应同时满足:a)血细胞比容(Hct):≥0.36b)采前血小板计数(Plt):≥150×109/L且<450×109/Lc)预测采后血小板数(Plt):≥100×109/L。

6 献血量及献血间隔6.1 献血量6.1.1 全血献血者每次可献全血400ml,或者300ml,或者200ml。

6.1.2 单采血小板献血者:每次可献1个至2个治疗单位,或者1个治疗单位及不超过200ml血浆。
全年血小板和血浆采集总量不超过10 L。
注:上述献血量均不包括血液检测留样的血量和保养液或抗凝剂的量。

6.2 献血间隔6.2.1 全血献血间隔:不少于6个月。
6.2.2 单采血小板献血间隔:不少于2周,不大于24次/年。

因特殊配型需要,由工作人员批准,更短间隔时间不少于1周。

6.2.3 单采血小板后与全血献血间隔:不少于4周。
全血献血后与单采血小板献血间隔:不少于3个月。
献血者知情同意及健康状况征询表尊敬的朋友:!感谢您参加无偿献血。
为了您本人的健康和受血者的安全,请您认真阅读并如实填写问卷中的各项内容。
下列任何问题即使您回答“是”也不一定表示您今天或以后不可以献血。
如有任何疑问,请向医护人员咨询。
谢谢您的理解与支持。
第一部分 献血前应知内容
1、安全的血液可挽救生命,不安全的血液却能危害生命。
安全的血液只能来自于以利他主义为动机和具有健康生活方式的献血者。
请高危行为者(如有静脉药瘾史、男男性行为、艾滋病或性病等)不要献血。

若明知有高危行为而故意献血,造成传染病传播、流行的,根据《中华人民共和国传染病防治法》第77条、《艾滋病防治条例》第38条和第62条规定,可被追究相应的民事责任。
2、请不要为了化验而献血。

国家提供艾滋病免费咨询和检测服务,如有需要,请与当地疾病控制中心联系。
3、为了对您的健康状况和是否适宜献血进行评价,您需要如实填写健康状况征询表。

如果表中提问涉及到您的隐私或令您感到不舒服,请您谅解。
4、《血站管理办法》规定,献血者在献血前应出示真实的身份证件,血站应进行核对并登记,请给予支持。

5、如果您认为已捐献的血液可能存在安全隐患,请在第一时间内告诉我们(联系电话:XXXXXXXX)。
6、献血过程是安全的。
血液采集使用一次性无菌耗材以保证献血者安全。
有些人偶尔会出现如穿刺部位青紫、出血或疼痛、献血后头晕等不适,这些不适都是轻微或短暂的。
恳请每位献血者遵照献血前、后应注意的事项,以减低献血不适发生的可能。
7、血站严格遵从国家规定进行血液检测,将检测合格的血液用于临床,不合格血液将按照国家规定处理。
血液检测结果不合格仅表明您所捐献的血液不符合国家标准的要求,不能作为感染或疾病的诊断依据。
8、根据《传染病防治法》规定,血站将艾滋病等检测阳性的结果及其个人资料向当地疾病控制中心报告。
我们承诺对您的相关信息严格保密。
第二部分 献血前健康征询(请以“√”表示)今日/现时是否
1、您是否觉得今天的身体状况适合献血?

2您是否正等待医院的检验报告或正接受某种治疗?
3、今天献血后您是否会参加危险性的运动(如:爬山、潜水或滑翔)?
驾驶重型汽车?
从事地下或高空作业(如:飞行、消防员、棚架工作)?
4、您献血的目的之一,是不是想了解您身体是否健康?

有没有染上艾滋病病毒或梅毒或其他疾病?
5、您是否知道,如果感染了艾滋病病毒或梅毒,即使感觉无恙,检验结果呈阴性,也可能将病毒传播给他人?
6、(女性填写)您现在是否处于月经期及前后三天?

是否已怀孕?
是否在过去一年内分娩或六个月内流产?
□□□□□□□□□□□□在过去24小时内7、是否曾经注射类毒素、灭活或基因工程技术制成的疫苗(包括霍乱、伤寒、白喉、破伤风、甲型肝炎、乙型肝炎、流行性感冒、脊髓灰质炎或百日咳等,且并无病症或不良反应出现?
□□在过去3天内8、是否曾接受任何口腔护理(包括洗牙等)?
□□在过去5天内9、是否服用阿司匹林或含阿司匹林的药物?
□□在过去1周内10、您是否有发热、头痛或腹泻?

是否曾患有感冒、急性胃肠炎?

是否有任何未愈合的伤口或皮肤炎症?
□□在过去2周内1
1、是否曾拔牙?
是否曾患有广泛性炎症?
是否有其他小手术?
□□12、是否曾经注射减毒活疫苗,如麻疹、腮腺炎、黄热病、脊髓灰质炎等?

□□在过去4周内13、是否曾接触传染病患者,如:水痘、麻疹、肺结核等?
14、是否曾接受减毒活疫苗注射,如:伤寒疫苗、风疹活疫苗、狂犬病疫苗、 水痘疫苗?
15、是否曾有不明原因的腹泻?

在过去一年内□□□□□□16、是否曾纹身、穿耳或曾被使用过的针刺伤等?
是否曾意外接触血液或血液污染的仪器?
17、是否曾注射乙型肝炎免疫球蛋白?
18、曾被动物咬伤并因此注射狂犬疫苗?
19、是否曾接受外科手术(包括内窥镜检查、使用导管作治疗等)?
或接受输血治疗?
□□□□□□□□健康史情况20、您是否曾有下述情况:接受凝血因子治疗?
接受脑垂体激素药物如生长激素治疗?
您本人或直系亲属是否患克雅氏病(疯牛病)?
是否曾有晕厥、痉挛、抽搐或意识丧失?
是否对某些药物产生过敏反应?
如曾感染过猪带绦虫、蛔虫、蛲虫等,是否已治愈?

是否曾患有肺结核或肺外结核?
是否被告知永久不能献血?
□□2
1、是否曾患有任何严重疾病?
□□循环系统疾病(例如:冠心病、高血压病、心脏瓣膜病等)呼吸系统疾病(例如:支气管哮喘、支气管扩张、慢性支气管炎、肺气肿等)消化系统疾病(例如:胃溃疡、十二指肠溃疡、溃疡性结肠炎等)血液系统疾病(例如:溶血性贫血、再生障碍性贫血、凝血性疾病等)恶性肿瘤(例如:胃癌、食管癌、肺癌、白血病等)内分泌及代谢性疾病(例如:糖尿病、甲状腺功能亢进等)神经系统疾病(例如:癫痫、脑出血等)精神系统疾病(例如:抑郁症、躁狂症等)泌尿及生殖系统疾病(例如:肾、膀胱、尿道疾病等)免疫系统疾病(例如:红斑狼疮、风湿性关节炎等)慢性皮肤病患者(例如:黄癣、广泛性湿疹、全身性牛皮癣等)严重寄生虫病(例如:血吸虫病、丝虫病、吸虫病等)其他严重疾病22、是否曾患有传染病或性病?12个月内是否曾患有甲型肝炎?

病毒性肝炎血液检测阳性?
如:乙型肝炎、丙型肝炎。
是否患有淋病、 尖锐湿疣等?
3年内是否患有疟疾?
12个月内是否曾前往疟疾流行区?
□□生活习惯23、您是否曾有下述情况:您是否曾滥服药物或注射毒品?
您是否曾接受(或给予)金钱而与他人发生性行为?
如您是男性,您是否曾与另一男性发生性行为?
您是否同时期有多个性伙伴?

其他您认为不适宜献血的情况24、在过去的12个月里,您是否曾与下列人士发生过性行为?
被怀疑感染了HIV(艾滋病病毒)或HIV检测呈阳性的人士?
滥服药物或注射毒品的人?
从事提供性服务的男士或女士?
有双性性行为的男士?
其他您认为不适宜献血的情况□□□□旅行情况:25、自1980年起,您是否曾居住在欧洲国家五年或以上,或于英国接受过输血?
26.1980年至1996年间,您是否曾居住于英国、爱尔兰、法国3个月或以上?
□□□□27、您是否曾在传染病区(如鼠疫、霍乱、黄热病、疟疾等)居住或工作过?

□□献血者签字: 医务人员签字:日期: 年 月 日 日期: 年 月 日第三部分 献血者登记表姓名性别年龄民族国籍证件类别□身份证□护照 □军人证□驾照 □其他职业□学生 □商业服务人员 □办事人员 □单位负责人 □专业技术人员 □医务工作者 □军人 □其他( )文化程度□大学以上□大学□大专□高中□中专□初中及以下居住状况□本地户籍_____区 □非本地户籍居住六个月以上 □非本地户籍居住六个月以内固定通讯地址邮政编码联系方式移动电话:固定电话:电子邮箱:其他(如QQ):既往献血史□首次□再次上次献血类型:□全血□成分血上次献血时间: 年 月 日个人意愿是否需要献血提醒: □是 □否是否愿意参加应急献血:□是 □否献血者知情同意书本人已理解以上内容,并已知悉献血的整个过程。
本人在健康征询表和献血者登记表中所提供的资料正确无误,并同意按规定对血液进行相关检测及使用。
本人理解献血的血液检测结果只是安全输血的需要,不能用于疾病诊断或其他目的。
本人愿意承担因提供虚假资料和信息所带来的一切后果。

献血者签字: 日期: 年 月 日献血前检查记录一般体格检查一般检查(以√表示正常 ×不正常): 皮肤、巩膜无黄染□ 皮肤无创面感染、无大面积皮肤病□四肢无严重功能障碍及关节无红肿□ 双臂静脉穿刺部位无皮肤损伤且无穿刺痕迹□体 重千克血 压/Kpa脉 搏次/分体温正常□ 不正常□___℃检查结论:体检者签名:日期: 年 月 日献血前检测必查项目血色素(血比重): 符合要求□不符合要求□单采血小板捐献增加以下项目:采前血小板计数:×109/L, Hct:其他血液成分_____捐献及增加项目:选择性项目: 血型ALTHBsAg HIV其他_________检测结论:□合格□不合格 检测者签名: 日期: 年 月 日总评估意见□可以献血 □不宜献血____□暂缓献血(□血压 □血色素 □化验检测 □其他___)本次献血全血□200ml □300ml □400ml成分献血单采血小板 □1单位 □2单位 □200ml血浆□其他:医务人员签名:日期: 年 月 日献血者签名:日期: 年 月 日采血记录采血袋用前检查: □已检查完好“可以献血及献血量”确认:可以献血___身份证件核对:正确□ 不正确□标识一致性核对□采血袋 □征询表 □检验试管□留样导管 □配血导管采血量全血□200ml□300ml□400ml□采血量不足成分献血□1单位 □2单位 □200ml血浆□其他___采血时间开始时间:分 秒结束时间:分 秒采血过程□顺利(□左臂 □右臂)□二次穿刺 (□左臂 □右臂 □双臂) □其他,请说明:献血不良反应□有 □无处置记录(请说明症状、体征、处理及转归):处置人签名:采血者签名:采血日期:年 月 日备注。
艾滋病试纸是测抗原还是抗体
艾滋病检测试纸检测准确吗?不当的性行为会感染艾滋病,人们很早的就发现了这个问题,但很少有人能够抵挡那些诱惑。
如今我国因为性接触感染艾滋病已经占到了新发感染的87%,并且这一比例还在连年上升中。
会感染艾滋病的行为主要有,男男性行为、静脉吸毒、性工作者和嫖娼行为、网络交友、一夜情婚外情、经常更换性伴侣的人群都要及时检测艾滋病,以免耽误病情或者将HIV病毒扩散传播。

艾滋病检测方法有很多种,比如P24抗原检测、HIV抗体检测、艾滋病核酸检测等,艾滋病试纸检测的是HIV抗体。
医院和疾控中心会建议人们做艾滋病抗体检测,这主要是因为抗体是更稳定的一个检测标的物,几乎在艾滋病感染后的99%的时间都存在,而抗原和其他检测指标就不行了,不具有确诊和排除的意义。
那么使用艾滋病试纸自测会准确吗?艾滋病检测试纸检测艾滋病准确吗艾滋病检测试纸是用于自测的一种检测方法,目前不仅用于门诊、急诊、血站、疾控等部门,艾滋病试纸也被用于做家庭自测,试纸主要针对血液或者口腔黏膜渗出液做HIV抗体检测,如果抗体阳性就会显示两条红线,如果抗体阴性就显示一条线。
艾滋病试纸分为血液检测试纸或者唾液检测试纸,这要看具体的品牌和种类。
不管哪种艾滋病试纸都是经过药监局批准上市的,准确率和质量都能得到保证,比如市场上销售的更好的万孚HIV检测试纸,准确率可达到99.7%以上。
目前我国不安全性行为是非常普遍的,社会上也有很多不良现象都为艾滋病传播创造了条件,比如,商业应酬、网络交友、找小姐、包二奶养小三、一夜情,总之如今的人们越来越拿性道德不当回事,小青年们未婚同居,频繁更换性伴侣也是常事儿,耽美小说充斥网络,让男人也萌发了小攻和小受的兴趣,殊不知男男同性性行为是更容易感染艾滋病的危险行为。
总之,不安全性行为的增多让普通人也面临感染艾滋病的危险。

本文来自投稿,不代表爱孕网立场,如若转载,请注明出处:https://www.aiywan.com/yqbk/33354.html

评论列表(128条)
2024-04-29~暂无数据~